
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是
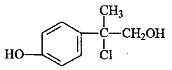
A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验及其现象,所得出的结论合理的是( )
选项 | 实验 | 现象 | 结论 |
A | 向 | 先有白色沉淀生成,后有蓝色絮状沉淀生成 | Ksp: |
B | 用pH试纸分别检验等浓度 | 前者试纸变蓝比后者更深些 |
|
C | 分别加热蒸干 | 前者能得到 |
|
D | 向某钠盐中滴加盐酸,产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐为 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据叙述,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇(液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为______________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其热化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A,其相对分子质量为104,碳的质量分数为92.3%。
(1)芳香烃A的分子式为_________,其名称为_____________。
(2)A可与溴的四氯化碳溶液反应,其化学方程式为____________________,该反应类型为_______。
(3)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式____________。
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C分别是三种有机物的结构模型:
A.![]() B.
B.![]() C.
C.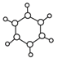
请回答下列问题:
(1)A和氯气在光照条件下发生反应的装置如图所示。
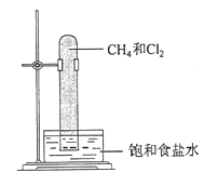
实验中可以观察到试管内壁上出现_____________;写出甲烷和氯气发生取代反应生成气态有机物的化学方程式_____________。
(2)A、B、C三种有机物中,所有原子均共面的有_____________(填结构简式)。
(3)等质量的以上三种物质完全燃烧时耗去O2的量最多的是_____________(填结构简式)。
(4)有机物C具有的结构或性质是_____________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构b.有毒、不溶于水、密度比水小
c.不能使酸性KMnO4溶液褪色d.一定条件下能与氢气或氧气反应
(5)已知C的同分异构体有多种,其中一种为![]() ,其一氯代物的同分异构体有________种。
,其一氯代物的同分异构体有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
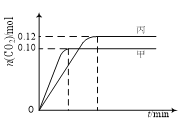
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的大
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路由正极流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热法是铝与某些金属氧化物反应获得高熔点金属单质的方法。工业上可用于制造无碳或低碳铁合金。铝粉和赤铁矿发生铝热反应的化学方程式为:Fe2O3+2Al![]() 2Fe+Al2O3。
2Fe+Al2O3。
(1)上述反应中,作为氧化剂的物质是__,化合价升高的元素是__。
(2)若反应中消耗了0.2molAl,生成Fe的物质的量为__mol,转移电子的物质的量为__mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com