
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
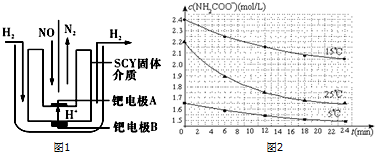
分析 (1)由电解池原理可知,内电路中阳离子移向阴极,读图可知,钯电极A为阴极、钯电极B为阳极;由电子、电荷、原子守恒可知,酸性环境下阴极发生还原反应;
(2)根据难溶电解质的溶度积常数表达式进行计算,5mL工业废水中滴加2滴硝酸银溶液,体积几乎不变,则c(NO2-)=1.0×10-4mol/L,c(Ag+)=0.1mol/L×0.1mL×$\frac{1}{5min}$=0.002mol/L,c(NO2-)•c(Ag+)=2.0×10-7mol2•L-2>Ksp(AgNO3)=2×10-8,则证明能看到有沉淀生成;
(3)断裂化学键吸收的能量为2×436+255=1127kJ,形成化学键放出的能量为4×339=1356kJ,反应焓变△H=反应物键能总和-生成物键能总和;
(4)①根据表中数据,25.0℃时的分解平衡常数K=c(CO2)•c2(NH3),可知平衡时容器内气体的浓度之比为2:1,由总浓度求出NH3、CO2 的平衡浓度,最后代入平衡常数的表达式来计算;
②由图象数据可以得出,用不同初始浓度,不同温度下的平均速率的大小来说明,25.00C时反应物的起始浓度较小,但0-6min的平均反应速率(曲线的斜率)仍比15.00C的大.
解答 解:(1)由电解池原理可知,内电路中阳离子移向阴极,读图可知,钯电极A为阴极、钯电极B为阳极;由电子、电荷、原子守恒可知,酸性环境下阴极发生还原反应,则钯电极A的电极反应式为:2NO+4H++4e-=N2+2H2O,
故答案为:阳;2NO+4H++4e-=N2+2H2O;
(2)2滴溶液所消耗的亚硝酸钠:n(NO2-)=$\frac{2}{20}$mL×0.1mol/L=0.01 mmol,
则C(NO2-)•C(Ag +)=$\frac{0.01}{5}$mol/L×1.0×10-4 mol/L=2.0×10-7>KSP(AgNO2)=2×10-8 mol2•Lˉ2,则证明能看到有沉淀生成.
故答案为:2滴溶液中:n(NO2-)=$\frac{2}{20}$mL×0.1mol/L=0.01 mmol,则C(NO2-)•C(Ag +)=$\frac{0.01}{5}$mol/L×1.0×10-4 mol/L=2.0×10-7>KSP(AgNO2)=2×10-8 mol2•Lˉ2),则证明能看到有沉淀生成;
(3)断裂化学键吸收的能量为2×436+255=1127kJ,形成化学键放出的能量为4×339=1356kJ,则热化学方程式2H2(g)+S2(g)=2H2S(g)的△H=1127KJ/mol-1356KJ/mol=-229KJ/mol,
故答案为:-229KJ/mol;
(4)①根据表中数据,NH2COONH4(s)?2NH3(g)+CO2(g),25.0℃时的分解平衡常数K=c(CO2)•c2(NH3)=[4.8×10-3×$\frac{2}{3}$]2×[4.8×10-3×$\frac{1}{3}$]=1.64×10-8.
故答案为:K=c(CO2)•c2(NH3)=[4.8×10-3×$\frac{2}{3}$]2×[4.8×10-3×$\frac{1}{3}$]=1.64×10-8;
②因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
点评 本题考查电解原理的应用,沉淀溶解平衡的应用,化学图象的分析与判断、平衡常数的计算等,掌握基础是解题关键,题目难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 炒菜时加入一些料酒和食醋,这样可使菜变得味香可口,这是因为有酯类物质生成 | |
| B. | 禁止使用工业酒精配制料酒,这是因为工业酒精中常含有少量会使人中毒的甲醇 | |
| C. | 苯酚不小心蘸到皮肤上,应用NaHCO3溶液擦洗 | |
| D. | 夏季蚊虫较多,一旦被叮咬,就会感到皮肤瘙痒,这是由于蚊虫的分泌液中含有甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑦ | B. | ②④⑥⑧ | C. | ③④ | D. | ①③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解可获得乙烯、丙烯和丁二烯 | |
| B. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| D. | 酚醛树脂、聚酯纤维(涤纶)都是由缩聚反应制得的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A2)=0.4 mol•L-1•s-1 | B. | v(B2)=0.8 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化镁的分子式为MgCl2 | B. | 氮原子的轨道表达式为: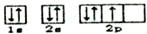 | ||
| C. | 硫原子的外围电子排布式为3s23p4 | D. | N2的结构式: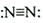 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
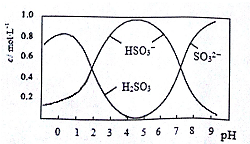
| A. | 向pH=4的溶液中滴加BaCl2溶液,会有白色沉淀产生 | |
| B. | pH=4.5时c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | pH=5时c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | |
| D. | 向pH=5.5的溶液中滴加溴水,反应的离子方程式为H2SO3+Br2+H2O=4H++SO42-+2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 反应物 | 催化剂 | 温度 |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol/LFeCl3溶液 | 40℃ |
| A. | 实验④反应速率最快 | |
| B. | 实验①反应速率最慢 | |
| C. | 实验②速率小于实验④的速率,只是因为实验④加入了催化剂 | |
| D. | 加入催化剂,能增大活化分子百分数,从而加快化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com