

 ;CsCl属于简单立方晶胞,8个Cl- (或Cs+)位于立方体的八个顶点,立方体中心为Cs+(或Cl-),所以每个Cs的周围,有8个Cl-,每个Cl-周围有8个Cs+,15NH4Cl的晶胞与CsCl相同,即阴阳离子的配位数均为8;铵根离子中氮原子含有4个δ键且不含孤电子对,所以其采用sp3杂化,故答案为:
;CsCl属于简单立方晶胞,8个Cl- (或Cs+)位于立方体的八个顶点,立方体中心为Cs+(或Cl-),所以每个Cs的周围,有8个Cl-,每个Cl-周围有8个Cs+,15NH4Cl的晶胞与CsCl相同,即阴阳离子的配位数均为8;铵根离子中氮原子含有4个δ键且不含孤电子对,所以其采用sp3杂化,故答案为: ;8;sp3杂化;
;8;sp3杂化;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市松江区高三上学期期末(一模)考试化学试卷(解析版) 题型:填空题
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围 ;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市高三第二次诊断性考试理综化学试卷(解析版) 题型:填空题
利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是___。
A.14N与15N为同种核素
B. 14N的第一电离能小于14C
C. 15NH3与14NH3均能形成分子间氢键
D. CH315NH2与CH3CH214NH2互为同系物
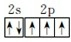
(2)15N的价层电子排布图为_______15NH4Cl的晶胞与CsCl相同,则15NH4Cl晶体中15NH4+的配位数为_______;15NH4+中I5N的杂化轨道类型为_______。
(3) 工业上电解法处理亚硝酸盐的模拟工艺如图。
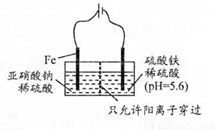
已知:阳极区发生化学反应:
2NO2-+8H++6Fe2+==N2↑ +6Fe3++4HzO
①阳极电极反应方程式是______(不考虑后续反应);
②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为______(填化学式);该现象表明c( H+ )越大,H+氧化性越______;
③若电解时电路中有0.6 mol电子转移,且NaNO2有剩余,则电解池中生成Na2SO4 ______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com