
短周期非金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是

A.原子半径:甲<乙
B.非金属性:乙<丁
C.最高价氧化物的水化物的酸性:丙<丁
D.最外层电子数:丙>丁>戊
C
【解析】
试题分析:A.同一周期的元素,原子序数越大,原子半径就越小。由于原子序数乙>甲,所以原子半径:甲>乙,错误;B.乙、丁是同一主族的元素,由于从上到下,元素的原子半径逐渐增大,原子吸引电子的能力逐渐减弱,所以元素的非金属性逐渐减小。因此元素的非金属性:乙>丁,错误;C.丙、丁是同一周期的元素,随着原子序数的增大,元素的非金属性逐渐逐渐增强。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。由于元素的非金属性:丁>丙,所以酸性:丙<丁,正确;D.同一周期的元素,原子序数越大,原子的最外层电子数就越多。原子序数:丙<丁<戊,所以原子的最外层电子数:丙<丁<戊,错误。
考点:考查元素的原子结构与元素的性质、位置的关系的知识。
考点分析: 考点1:物质的结构与性质 考点2:元素周期律与元素周期表 试题属性

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源:2014-2015学年浙江省高三第二次模拟理综化学试卷(解析版) 题型:实验题
(15分)某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:

(1)溶解硼砂时需要的玻璃仪器有:烧杯和___________。
(2)用pH试纸测定溶液pH的操作方法为__________________________________。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为_________________________。
(4)实验流程中缺少的步骤a、步骤b操作分别为_________、_________。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:

滴定步骤为:

①滴定到终点时溶液颜色变化是______________________________________。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为__________________(假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果_____。(选填:“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:选择题
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图,有关说法正确的是

A.转移0.1 mol电子时,a电极产生1.12 L H2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e- = 2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:选择题
下表为元素周期表前四周期的一部分,下列叙述正确的是
X | |||
Y | Z | R | |
W | |||
A.Y单质在空气中燃烧生成YO3
B.Z元素的最高价氧化物的水化物酸性最强
C.X的氢化物为H2X
D.Y、Z和W的阴离子半径依次增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:
2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:

①从上表可以推断:该反应的逆反应是 (填“吸”、“放”)热反应。
②此温度下该反应的平衡常数表达式为K=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。

②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)Li2O、Na2O、MgO均能吸收CO2。
①如果寻找吸收CO2的其他物质,下列建议合理的是________。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是__________________ _________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:实验题
(16分)过氧化钙在常温下是无色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂,常用于种子消毒、药物制造、鱼池增氧等。
I.某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)

(1)A为实验室制取氨气的装置,则A中试管所装的试剂的名称为 。
(2)仪器B的作用是 。
(3)写出生成CaO2·8H2O的离子方程式 。
(4)制取CaO2·8H2O一般在0~5℃的低温下进行,原因是 。
II.该实验小组欲通过测量气体的体积来探究CaO2与SO2反应的特点。装置如下图:
(硬质玻璃管中为无水CaO2)
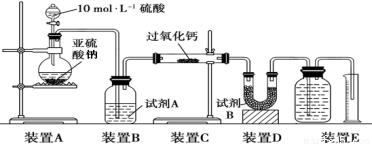
【提出假设】
假设1:反应只发生2SO2+2CaO2=2CaSO3+O2,SO2未被氧化;
假设2:反应只发生SO2+CaO2=CaSO4,SO2完全被氧化;
假设3:上述两个反应均发生,SO2部分被氧化。
【实验探究】
(5)该实验装置有一处明显错误,请改正 。
(6)试剂A为浓硫酸,试剂B的作用是 。
【实验数据处理】实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,
装置E中收集到的气体为V L(已换算成标准状况下)。
(7)在记录量筒中的液面位置时,除视线平视外,还应 。
(8)如果假设3成立,则V的取值范围是 【M(CaO2)=72,M(CaSO3)=120】。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.向次氯酸钙溶液通入过量CO2:Ca2+ + 2ClO- + H2O + CO2 = CaCO3↓ + 2HClO
B.向次氯酸钙溶液通入少量SO2:Ca2+ + 2ClO- + H2O + SO2 = CaSO3↓ + 2HClO
C.Ba(OH)2溶液加入过量Al2(SO4)3:3Ba2++6OH—+2Al3++3SO42— 3BaSO4↓+2Al(OH)3↓
D.向Mg(HCO3)2溶液中加入过量澄清石灰水:Mg2++2HCO3—+2OH一+Ca2+ MgCO3↓+CaCO3↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,均含有相同的某种元素。在一定条件下它们之间存在如下转化关系:

下列说法中错误的是
A.甲可能是单质,也可能是化合物
B.丁可能是酸,也可能是碱
C.反应①②一定是氧化还原反应
D.反应③一定是化合反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省盟校高三第一次十校联考理综化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值,下列有关叙述不正确的是
A.在熔融状态下,l mol Na2O2 完全电离出的离子数目为3 NA
B.将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数mNA/14
C.在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA
D.含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com