
| A、CaO溶于水 |
| B、红热的铁粉和水蒸气 |
| C、金属钠投入水中 |
| D、Na2O2投入水中 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L任何气体的物质的量均为1mol |
| B、0.1molH2、0.2molO2、0.3molN2、和0.4CO2组成的混合物气体在标准状况下的体积约为22.4L |
| C、非标准状况下,1mol任何气体的体积必定不是22.4L |
| D、任何状况下1molCO2和18gH2O所含的分子数和原子数都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-═CO32-+H2O |
| B、氯化铝溶液中加入过量浓氨水:Al3++4OH-═AlO2-+2H2O |
| C、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、碳酸钙和盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 10 | 0.2 | 5 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,11.2 L的甲烷气体含有甲烷分子数为0.5NA个 |
| B、标准状况下,11.2 L SO3中含有个0.5NA个SO3分子 |
| C、常温下14 g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、1L0.1mol?L-1Na2SO3溶液中含有SO32-的个数小于0.1NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 液体 | 固体 | 混合前温度 | 混合后最高温度 |
| ① | 35mL水 | 2.5g NaHCO3 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2g Na2CO3 | 20℃ | 24.3℃ |
| ③ | 35mL盐酸 | 2.5g NaHCO3 | 20℃ | 16.2℃ |
| ④ | 35mL盐酸 | 3.2g Na2CO3 | 20℃ | 25.1℃ |
| A、仅通过实验③即可判断反应Ⅰ是吸热反应 |
| B、仅通过实验④即可判断反应Ⅱ是放热反应 |
| C、通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应 |
| D、通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
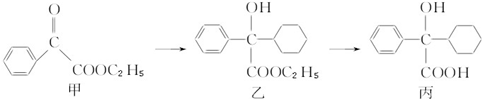
| A、化合物乙能发生消去反应,且生成的有机物能和Br2发生加成反应 |
| B、化合物丙能和FeCl3溶液发生显色反应 |
| C、化合物甲中的含氧官能团有羰基和酯基 |
| D、化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com