
 的单体是( )
的单体是( )| A. | 氯乙烯 | B. | 氯乙烯和乙烯 | C. |  | D. |  |
分析 高聚物单体的判断方法:凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合;凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换.
解答 解: 中,主链上有四个碳原子并存在碳碳双键结构,根据规律“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换,得到其单体为
中,主链上有四个碳原子并存在碳碳双键结构,根据规律“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换,得到其单体为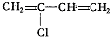 .
.
故选C.
点评 本体考查根据高聚物的结构简式来寻找单体的方法,其规律是“见双键,四个碳,无双键,两个碳”,难度不大.


科目:高中化学 来源: 题型:填空题
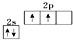 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x:m:n=1:2:1 | B. | m:n=2:1 | C. | m>2x+2 | D. | m=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离碘酒中的碘和酒精 | B. | 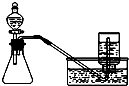 用铜和浓硝酸制取少量NO2 | ||
| C. | 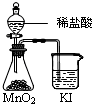 比较MnO2、Cl2、I2的氧化性 | D. | 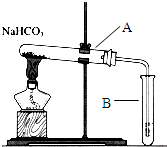 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 0.1 mol•L-1 NaHS溶液中:c(H+)+c(H2S)=c(S2-)+c(OH-) | |
| D. | 物质的量浓度相等的HF和NaF溶液等体积混合后:c(Na+)=c(HF)+c(F-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
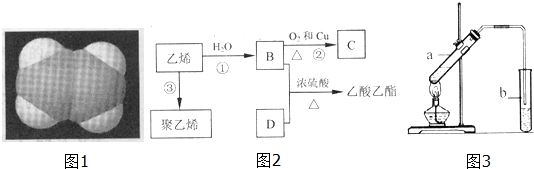
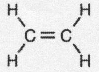 .
.
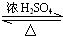 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com