
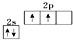
 .
.分析 (1)基态碳原子的核外电子排布为1s22s22p2,根据洪特规则、泡利原理画出价电子排布图;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,则晶胞中水分子处于顶点、面心,且晶胞内部有4个水分子;
(4)反应前碳原子的杂化方式为sp2,反应后变为sp3,乙烯与溴放出加成反应生成 1,2-二溴乙烷符合;
(5)原子总数相同、价电子总数相同的微粒互为等电子体.
解答 解:(1)基态碳原子的核外电子排布为1s22s22p2,根据洪特规则、泡利原理画出价电子排布图为 ,故答案为:
,故答案为: ;
;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,故答案为:N>O>C;
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,则晶胞中水分子处于顶点、面心,且晶胞内部有4个水分子,每个冰晶胞平均占有水分子为4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,故答案为:8;
(4)反应前碳原子的杂化方式为sp2,反应后变为sp3,乙烯与溴放出加成反应生成 1,2-二溴乙烷符合,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(5)原子总数相同、价电子总数相同的微粒互为等电子体,与CO分子等电子体的分子式为N2,故答案为:N2.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、晶胞计算、杂化方式、等电子体等,(3)为易错点,注意识记中学常见晶胞结构.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、OH-、NH4+、Na+ | |
| B. | c(H+)水=1.0×10-12mol•L-1的溶液中:S2-、Na+、OH-、K+ | |
| C. | S2-、Cl-、Al3+、SO42- | |
| D. | S2-、K+、Fe3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与足量氯气反应时转移的电子数为3NA | |
| B. | 1L2mol•L-1 K2S溶液中S2-和HS-的总数为2NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜微热反应,转移的电子数为1.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下(如图)化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下(如图)化合物. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,聚乳酸是由单体之间通过加聚而合成
,聚乳酸是由单体之间通过加聚而合成 )和丙氨酸(
)和丙氨酸( )缩合最多可形成4种二肽
)缩合最多可形成4种二肽 的系统命名法的名称为2,2,3-三甲基戊烷.
的系统命名法的名称为2,2,3-三甲基戊烷.| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com