
【题目】铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根据上述情况判断:
2PbSO4(s)+2H2O(l)。根据上述情况判断:
(1)放电时,电解质溶液的pH________(填“增大”“减小”或“不变”)。
(2)放电时,电解质溶液中阴离子移向_____极,电子从_____极流向____极。
(3)写出负极的电极方程式:_____________________________________。
【答案】增大 负 负 正 Pb -2e-+SO4 2-=PbSO4
【解析】
放电时,负极发生氧化反应,Pb失去电子产生Pb2+,Pb2+与溶液中的SO42-结合形成PbSO4,反应消耗硫酸,硫酸的浓度减小,负极得到PbSO4,正极上PbO2获得电子变为Pb2+,Pb2+与溶液中的SO42-结合形成PbSO4,电子由负极经外电路流向正极,由此分析解答。
(1)该电池总反应式为:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根据工作原理可知:在放电时Pb发生氧化反应,失去电子变为Pb2+,电极反应式为Pb-2e-=Pb2+;正极上PbO2获得电子变为Pb2+,电极反应式为:PbO2+4H++SO42-=PbSO4+2H2O,反应消耗硫酸,使硫酸的浓度减小,溶液中c(H+)降低,所以溶液的pH增大;
2PbSO4(s)+2H2O(l)。根据工作原理可知:在放电时Pb发生氧化反应,失去电子变为Pb2+,电极反应式为Pb-2e-=Pb2+;正极上PbO2获得电子变为Pb2+,电极反应式为:PbO2+4H++SO42-=PbSO4+2H2O,反应消耗硫酸,使硫酸的浓度减小,溶液中c(H+)降低,所以溶液的pH增大;
(2)放电时,由于负极不断产生Pb2+,使正电荷数目增大,所以电解质溶液中阴离子SO42-移向负极,电子从负极Pb极流向正极PbO2极;
(3)负极失去电子,发生氧化反应,负极的电极反应式:Pb+SO42--2e-=PbSO4。


科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。

(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
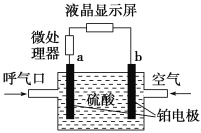
A.呼出气体中酒精含量越高,微处理器中通过的电流越小
B.电解质溶液中的H+移向a电极
C.b为正极,电极反应式为O2+2H2O+4e-=4OH-
D.a极上的电极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向Fe(NO3)2溶液中滴入HI和淀粉混合溶液,溶液变蓝 | 氧化性:Fe2+>I2 |
B | 向3 mL KI溶液中滴加几滴氯水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | Cl2的氧化性比I2的强 |
C | 向Ag2CO3白色悬浊液中滴加少量Na2S溶液,出现黑色沉淀 | Ksp(Ag2S)<Ksp(Ag2CO3) |
D | 苯和液溴在FeBr3的催化下发生反应,将得到的气体直接通入AgNO3溶液中,产生淡黄色沉淀 | 苯和液溴发生取代反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g) ![]() 2CO2(g)+S(l)。以疏松多孔的γAl2O3作为催化剂(其他条件相同),反应相同的时间,SO2的去除率随反应温度的变化如图所示(图中虚线表示相同条件下SO2的平衡去除率随温度的变化)。下列说法正确的是
2CO2(g)+S(l)。以疏松多孔的γAl2O3作为催化剂(其他条件相同),反应相同的时间,SO2的去除率随反应温度的变化如图所示(图中虚线表示相同条件下SO2的平衡去除率随温度的变化)。下列说法正确的是
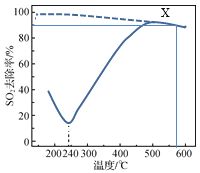
A.该反应的ΔH>0
B.180℃,SO2去除率较高的主要原因是SO2被γAl2O3吸附
C.500℃时,其他条件不变,采用高效的催化剂可以提高SO2去除率
D.X点恒容下再通入CO、CO2各0.1 mol,达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,一些水管的活塞会“自动”熔化,喷出水来。由一种铋矿(主要成分为Bi2S3,含强氧化性杂质PbO2等)制备金属铋的简单工艺如图:

已知:酸性溶液中,氧化性PbO2>KMnO4
回答下列问题:
(1)“浸出”时发生的离子反应包括___、___。
(2)浸出液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是___。
(3)检验母液中主要金属阳离子的方法是___。
(4)乙二胺四乙酸二钠盐(EDTA)可以和Bi3+1:1形成稳定的配合物,一种测定浸出液中Bi3+浓度的方法如下:取25mL浸出液,调节pH=l,滴入2滴二甲酚橙作指示剂(二甲酚橙:溶于水呈亮黄色,能和多种金属阳离子形成紫红色配合物),用0.01000mol/L的EDTA溶液滴定,达到滴定终点时,测得耗去标准液35.00mL,则浸出液中Bi3+的浓度为___g/L,达到滴定终点的现象是__。
(5)以Bi2(SiF6)3的水溶液为电解液,可以实现粗铋的电解精炼。电解过程中,当电路中通过0.3mol电子时,阴极析出的金属Bi的质量为__;电解一段时间后,电解液会有损失,并会出现大量杂质,加入___(填化学式)可以除去该杂质,并使电解液H2SiF6再生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。
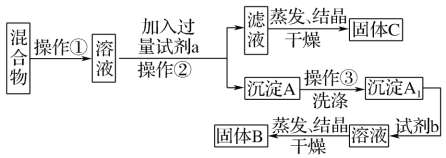
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。试回答下列问题:
(1)操作①的名称是____,操作②的名称是____。
(2)试剂a是_____(填化学式,下同),试剂b是____,固体B是____。
(3)加入试剂a所发生反应的化学方程式为_____。加入试剂b所发生反应的离子方程式为_____。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进?_____(若能,此问不用回答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com