
【题目】工业上回收利用某合金废料(主要含Fe、Al、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
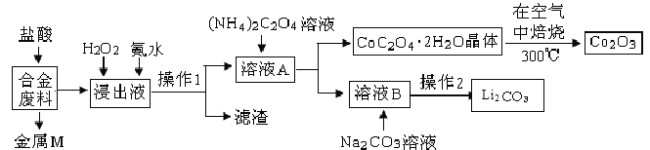
(1) 金属M为 ,操作1所用的玻璃仪器除烧杯外还有 。
(2) 加入H2O2的作用是 (用离子方程式表示),加入氨水的作用是 。
(3) 在空气中焙烧的化学方程式为 。
(4) 已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5) 用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
【答案】(1)Cu;漏斗、玻璃棒
(2)2Fe2++H2O2+2H+=2Fe3++2H2O;调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀
(3)4CoC2O42H2O+3O2![]() 2Co2O3+8 H2O+8CO2
2Co2O3+8 H2O+8CO2
(4)减少Li2CO3的溶解损失;(5)2CO32--4e-=O2↑+2CO2↑
【解析】
试题分析:合金废料(主要含Fe、Al、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液pH使铁离子转化为氢氧化铁沉淀、氢氧化铝,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O42H2O足量空气煅烧得到氧化钴。
(1)上述分析判断金属M为Cu,操作Ⅰ为过滤操作,所用的玻璃仪器除烧杯外还有漏斗和玻璃棒;
(2)加入H2O2的作用是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的作用是调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀;
(3)CoC2O4焙烧生成Co2O3、CO2和水,反应的化学方程式为4CoC2O42H2O+3O2![]() 2Co2O3+8 H2O+8CO2;
2Co2O3+8 H2O+8CO2;
(4)Li2CO3微溶于水,溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后必须趁热过滤;
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,应为二氧化碳和氧气,电极方程式为2CO32--4e-=O2↑+2CO2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.光照新制的氯水时。溶液的PH逐渐减少
B.增大压强,有利于SO2和O2反应生成SO3
C.可向浓氨水加入氢氧化钠固体快速制取氨
D.500℃左右比常温下更有利于合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断哪些是正确的
①氢氧化钠是电解质
②强电解质溶液的导电性一定比弱电解质溶液导电性强
③氯化银难溶于水,所以氯化银是非电解质
④蔗糖易溶于水,所以是电解质
⑤氯气溶于水后导电,所以Cl2是电解质
A.① B.①③ C.①②⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac![]() Pb(Ac)2+(NH4)2SO4。当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是( )
Pb(Ac)2+(NH4)2SO4。当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是( )
A. Pb(Ac)2+H2S![]() PbS↓+2HAc
PbS↓+2HAc
B. Pb2++H2S![]() PbS↓+2H+
PbS↓+2H+
C. Pb2++2Ac-+H2S![]() PbS↓+2HAc
PbS↓+2HAc
D. Pb2++2Ac-+2H++S2—![]() PbS↓+2HAc
PbS↓+2HAc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子式表示的各组物质一定互为同系物的是( )
A. C2H4和C5H10 B. C2H6和C5H12 C. C2H2和C5H8 D. C2H6O和C5H12O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医院里检测糖尿病的方法是将病人尿液加入到CuSO4和NaOH的混合液中,加热后产生红色沉淀说明病人的尿液中含有
A.脂肪 B.乙酸 C.葡萄糖 D.蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关铝及其化合物的说法错误的是( )
A.用于熔化烧碱的坩埚,可用Al2O3这种材料制成
B.铝能在空气中稳定存在是因为其表面覆盖着一层氧化铝薄膜
C.氧化铝是一种难熔物质,是一种较好的耐火材料
D.氢氧化铝能中和胃酸,可用于制胃药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1 所示),并测定电离平衡常数Kb。

(1)实验室制取氨气的化学方程式为_____________;
图1 中用浓氨水和X 固体快速制取NH3,X固体不可以是________(填序号)
A.生石灰 B.无水氯化钙 C.烧碱 D.碱石灰
(2)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c 口,_______(填操作)可引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2 所示。图2中________点时喷泉喷的最剧烈。
(3)喷泉实验结束后,发现水未充满三颈烧瓶(大约占体积的90 % ) ,如装置的气密性良好,烧瓶未充满水的原因是________________,所得氨水的物质的量浓度为________。
(4)从三颈瓶中用__________(填仪器名称)量取25. 00 mL氨水至锥形瓶中,用0.0500mol/LHCl 滴定测定氨水的浓度。用pH 计采集数据、电脑绘制滴定曲线如图3 所示。

当pH=11.0时,NH3·H2O电离平衡常数Kb的近似值,Kb≈_________。
(5)关于该滴定实验的说法中,正确的是_______(填序号)
A. 锥形瓶中有少量蒸馏水不影响测定结果
B.选择酚酞作为指示剂,测定结果偏高
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.滴定终点时俯视读数会导致测定结果偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com