
【题目】下表是A、B、C三种有机物的有关信息:
A | ①能使溴的四氧化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成C |
B | ①由C、H、O三种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与B反应生成相对分子质量为88的酯 |
请结合信息回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式____________________________,反应类型为______________。
(2)A与氢气发生加成反应后生成物质D,写出符合下列要求的有机物的结构简式:_______。
①与D互为同系物 ②分子中碳原子总数是4 ③分子里带有一个支链
(3)对于物质B有关说法正确的是_____ (填序号) 。
①无色无味液体 ②有毒 ③易溶于水 ④具有酸性,能与碳酸钙反应 ⑤官能团是-OH
(4)写出在浓硫酸作用下,B与C反应生成酯的化学方程式________________________________。
(5)下列试剂中,能用于检验C中是否含有水的是______ (填序号)。
①CuSO4·5H2O ②无水硫酸铜 ③浓硫酸 ④金属钠
【答案】 CH2=CH2+Br2→CH2BrCH2 Br 加成反应 ![]() ③④ CH3OOH+HOCH2CH3
③④ CH3OOH+HOCH2CH3![]() CH3COOCH2CH3+H2O ②
CH3COOCH2CH3+H2O ②
【解析】分析:A能使能使溴的四氧化碳溶液褪色,根据比例模型可判断A是乙烯。A能与水在一定条件下反应生成C,C由C、H、O三种元素组成,且能与Na反应,但不能与NaOH溶液反应,因此C是乙醇。C能与B反应生成相对分子质量为88的酯,根据质量守恒定律可知说明B的相对分子质量是88+18-46=60,B由C、H、O三种元素组成,根据B的球棍模型可知B是乙酸,结合物质的结构与性质解答。
详解:根据以上分析可知A是乙烯,B是乙酸,C是乙醇。则
(1)乙烯含有碳碳双键,能与溴的四氯化碳溶液发生加成反应,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br。
(2)乙烯与氢气发生加成反应后生成物质D是乙烷,①与D互为同系物,说明属于烷烃;②分子中碳原子总数是4,是丁烷;③分子里带有一个支链,应该是异丁烷,结构简式为![]() ;
;
(3)①乙酸是强烈有刺激性气味的无色液体,①错误;②乙酸没有毒,②错误;③乙酸易溶于水,③正确;④乙酸含有羧基,具有酸性,酸性强于碳酸,能与碳酸钙反应,④正确;⑤乙酸的官能团是-COOH,⑤错误,答案选③④;
(4)在浓硫酸作用下,乙酸与乙醇发生酯化反应生成酯的化学方程式为CH3OOH+HOCH2CH3![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
(5)一般用无水硫酸铜检验水的存在,实验现象是变为蓝色;钠与乙醇和水均反应产生气体,不能检验乙醇中是否含有水。浓硫酸具有吸水性,但无明显实验现象,答案选②。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0,△S>0
B. 常温下,NH4Cl溶液加水稀释 增大
增大
C. 电解饱和食盐水产生了11.2LH2,则反应中转移的电子数为6.02×1023
D. 在NaCl和KI均为0.1 mo1·L-1的混合溶液中滴加AgNO3溶液,则先产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、CH2=CH﹣COOH和油酸(C17H33COOH)
B、12C60和石墨
C、 ![]() 和
和 ![]()
D、35Cl和37Cl E、乙醇和乙二醇
(1)互为同位素的是;
(2)互为同系物的是;
(3)互为同素异形体的是;
(4)互为同分异构体的是;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述正确的是
A.Fe(OH)3胶体是纯净物
B.胶体是比溶液还稳定的分散系
C.胶体粒子直径在 1~100 nm之间
D.将饱和FeCl3溶液滴加到沸水中长时间加热制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2等杂质)经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是_________________________________。
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:___________________。
II.以TiO2为原料制备金属钛,流程如下:TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:___________________________________。
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________。
(5)己知碳的燃烧热394kJ/mol,请写出TiO2与Cl2、C反应制取TiCl4的热化学方程式_____________。
III.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:
![]()
(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O的转化率 | 80% | 90% | 97% | 93% | 82% |
该过程的理想温度为_______________,分析表中数据,解释TiO2·xH2O的转化率随温度变化的原因:_______________________________________,该反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和双原子分子M.(组成E分子的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.)如图,则下列判断中正确的是( ) 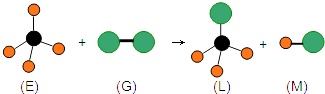
A.常温常压下,L是一种液态有机物
B.E中化学键是极性键
C.G有漂白性
D.上述反应的类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铜片加入到20 mL某浓度的浓硝酸中,充分反应后,铜片全部溶解,并收集到标准状况下的混合气体共896mL(假设[体中只有NO和NO2)。向反应后所得溶液中逐滴滴加lmol/L的NaOH溶液,产生沉淀质量与加入NaOH溶液体积(单位: mL)的关系如图所示。回答下列问题:
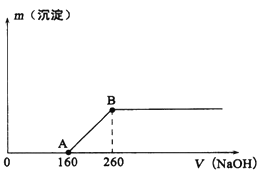
(1)B点所表示溶液中只含一种溶质,该物质是______(填化学式)。
(2)收集的气体中,NO2的物质的量为_______mol。
(3)原浓硝酸的浓度为_______mol/L。
(4)欲使铜与硝酸产生的混合气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要30%的双氧水______g(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com