
【题目】25℃时,用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1CH3COOH(Ka=1.75×10-5)溶液的过程中,消耗NaOH溶液的体积与溶液pH的关系如图所示。下列各项中粒子浓度关系正确的是
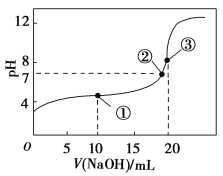
A.点①所示溶液中:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-)
B.点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.点③所示溶液中:c(CH3COO-)-C(CH3COOH)=c(Na+)+2c(H+)-2c(OH-)
D.pH=12的溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【答案】C
【解析】
A.点①时,NaOH溶液与CH3COOH溶液反应生成等物质的量浓度的醋酸和醋酸钠的混合溶液,溶液中的电荷守恒式为![]() ,溶液中的物料守恒式为
,溶液中的物料守恒式为![]() ,两式联立得c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-),A项错误;
,两式联立得c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-),A项错误;
B. 点②处溶液呈中性,c(OH-)=c(H+),B项错误;
C.点③处NaOH溶液与CH3COOH恰好反应生成醋酸钠,溶液中的电荷守恒式为![]() ,溶液中的物料守恒式为
,溶液中的物料守恒式为![]() ,两式联立得c(CH3COO-)-C(CH3COOH)=c(Na+)+2c(H+)-2c(OH-),C项正确;
,两式联立得c(CH3COO-)-C(CH3COOH)=c(Na+)+2c(H+)-2c(OH-),C项正确;
D. pH=12的溶液中c(Na+)>c(CH3COO-) >c(OH-)>c(H+),D项错误。
答案选C。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】已知常温下某二元酸发生如下电离:H2A=H++HA-;HA-![]() H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
A. NaHA溶液呈酸性,因为HA-的电离程度大于水解程度
B. 常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的108倍
C. 常温下pH=2的H2A溶液中c(A2-)小于c(HA-)
D. 0.1mol/LH2A溶液中c(A2-)+c(HA-)+c(H2A)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO、CO2的回收对减少碳的排放、改善生态环境和构建生态文明具有重要的意义。回答下列问题:
(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH=99 kJ·mol1
CH3OH(g) ΔH=99 kJ·mol1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ·mol1
CO(g)+H2O(g) ΔH=+41 kJ·mol1
则反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=_________。
CH3OH(g)+H2O(g) ΔH=_________。
(2)向容积相同的三个恒容密闭容器中分别通入一定量H2、CO,控制适当条件使其发生反应:2H2(g)+CO(g)![]() CH3OH(g),反应中有关数据如下表所示:
CH3OH(g),反应中有关数据如下表所示:
容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | |
c(H2) | c(CO) | c(CH3OH) | ||
A | 350 | 0.40 | 0.20 | 0.16 |
B | 350 | 0.80 | 0.40 | |
C | T | 0.40 | 0.20 | 0.05 |
反应从开始到达到平衡时,平均反应速率:容器A____容器C(填“>”或“<”,后同),容器B中CO的转化率____80%。
(3)①CO2和H2在一定条件下能发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
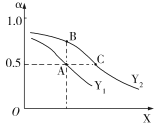
X表示___(填“温度”或“压强”),状态A、B、C对应的平衡常数K(A)、K(B)、K(C)的相对大小顺序为_____。
②向M、N两个初始容积相同的密闭容器中各充入2 mol CO2 和6 mol H2,控制适当条件使其发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
(4)用NaOH溶液做碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=10的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(
)=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O ![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑥反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
A. ①④ B. ②③ C. ②⑥ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命的源泉、工业的血液、城市的血脉。要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=________ mol·L-1。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为____________________,由水电离出的c(OH-)=________mol·L-1。
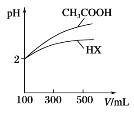
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
在25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )
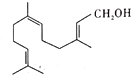
A.金合欢醇的同分异构体中不可能有芳香烃类
B.金合欢醇可发生加成反应、取代反应、氧化反应
C.金合欢醇分子的分子式为C15H26O
D.1 mol金合欢醇与足量Na反应生成0.5 mal氢气,与足量NaHCO3溶液反应生成1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.分子式为C4H8Cl2的有机物共有8种
C.含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D.菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]________,下列状态的铝中,电离最外层的一个电子所需能量最小的是_____________(填标号)。
A. ![]() B.
B. ![]() C.[Ne] D.
C.[Ne] D. ![]()
(2)8—羟基喹啉铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与 (8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______;
(8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______; 所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表中卤化物的熔点产生差异的原因是____________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_______;其中Al的配位数为_________。
(4)GaAs的晶胞结构如图所示,紧邻的As原子之间的距离为x,紧邻的As、Ga原子之间的距离为y,则![]() =________。
=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是()
3C+4D反应中,表示该反应速率最快的是()
A.v(A)=0.5 mol/(L·min) B.v(B)=0.3 mol/(L·min)
C.v(C)=0.8 mol/(L·min) D.v(D)=1 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com