
����Ŀ��GaN������5GоƬ�IJ��ϣ����������͵�����LED�ɷ�������⡣�ش��������⣺
(1)��̬Asԭ�Ӻ�������Ų�ʽΪ[Ar]________������״̬�����У�����������һ����������������С����_____________(����)��
A. ![]() B.
B. ![]() C.[Ne] D.
C.[Ne] D. ![]()
(2)8���ǻ������(����ʽC27H18AlN3O3)���ڷ�����ϼ����Ӵ�����ϣ�����LiAlH4�� (8���ǻ����)�ϳɡ�LiAlH4�������ӵĿռ乹��Ϊ_______��
(8���ǻ����)�ϳɡ�LiAlH4�������ӵĿռ乹��Ϊ_______�� ����Ԫ���е縺��������___(��Ԫ�ط���)��C��N��O���ӻ���ʽ����Ϊ _____��_________��____________��
����Ԫ���е縺��������___(��Ԫ�ط���)��C��N��O���ӻ���ʽ����Ϊ _____��_________��____________��
(3)��֪���л�������۵㣺
������ | AlF3 | GaF3 | AlCl3 |
�۵�/�� | 1040 | 1000 | 194 |
�ٱ���±������۵���������ԭ����____________��
������AlCl3ʱ�����ɾ��лӷ��ԵĶ�����Al2Cl6��������Al2Cl6�ĽṹʽΪ_______������Al����λ��Ϊ_________��
(4)GaAs�ľ����ṹ��ͼ��ʾ�����ڵ�Asԭ��֮��ľ���Ϊx,���ڵ�As��Gaԭ��֮��ľ���Ϊy����![]() =________��
=________��

���𰸡�3d104s24p3 D �������� O sp2 sp2 sp3 AlF3��GaF3Ϊ���Ӿ��壬AlCl3Ϊ���Ӿ��壬�����ܣ�AlF3>GaF3 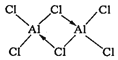 4
4 ![]()
��������
(1)AsΪ33��Ԫ�أ���ԭ�Ӻ�����33�����ӣ����ݹ���ԭ����д��̬ԭ�Ӻ�������Ų�ʽ������������һ������������������̬������̬����һ�����ܣ��ڶ������ܣ����������ܣ�
(2)LiAlH4��������ΪAlH4-�����ݼ۲���ӶԸ���=��������+�µ��ӶԸ��������жϸ���������Alԭ�Ӽ۲���ӶԸ��������жϸ������ӿռ乹�ͣ�Ԫ�صķǽ�����Խǿ����縺��Խ��8һ�ǻ�����л��ϵ�C��N��Oԭ�Ӽ۲���ӶԸ����ֱ�Ϊ3��3��4�����ݼ۲���ӶԻ��������ж�ԭ���ӻ����ͣ�
(3)��ԭ�Ӿ����۷е�ϸߡ����Ӿ����۷е�ϵͣ��ڶ�����Al2Cl6��Alԭ���пչ����Cl�����ṩ�µ��Ӷ��γ���λ����������е���λ����ֱָ��ͬ��������(��ԭ��)��λ��ԭ����Ŀ��
(4)���ݾ����ṹͼ������������ڵ�����Asԭ�ӵľ���Ϊ���㵽���ĵľ���ͽ��ڵ�As��Gaԭ��֮��ľ��롣
(1)AsΪ33��Ԫ�أ���̬ԭ�Ӻ�������Ų�ʽΪ[Ar]3d104s24p3�����ĵ��������ܣ��ڶ������ܣ���һ�����ܣ���̬���ڼ���̬������D�����������ͣ��ʴ�Ϊ��3d104s24p3��D��
(2)LiAlH4��������ΪAlH4-������������Alԭ�Ӽ۲���ӶԸ���=4+![]() =4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������жϸ������ӿռ乹��Ϊ�������壻Ԫ�صķǽ�����Խǿ����縺��Խ�ǽ�����O��N��C��H��Al����縺��O��N��C��H��Al��8һ�ǻ�����л��ϵ�C��N��Oԭ�Ӽ۲���ӶԸ����ֱ�Ϊ3��3��4�����ݼ۲���ӶԻ��������ж�ԭ���ӻ����ͣ�C��N��O�ӻ���ʽ�ֱ�Ϊ sp2��sp2��sp3���ʴ�Ϊ���������壻O��sp2��sp2��sp3��
=4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������жϸ������ӿռ乹��Ϊ�������壻Ԫ�صķǽ�����Խǿ����縺��Խ�ǽ�����O��N��C��H��Al����縺��O��N��C��H��Al��8һ�ǻ�����л��ϵ�C��N��Oԭ�Ӽ۲���ӶԸ����ֱ�Ϊ3��3��4�����ݼ۲���ӶԻ��������ж�ԭ���ӻ����ͣ�C��N��O�ӻ���ʽ�ֱ�Ϊ sp2��sp2��sp3���ʴ�Ϊ���������壻O��sp2��sp2��sp3��
(3)�����Ӿ�����۷е�ϸߡ����Ӿ����۷е�ϵͣ�����������ɼ��۵��ȷ��AlF3��GaF3Ϊ���Ӿ��壬AlCl3Ϊ���Ӿ��壬���Ӿ����۵�һ��ȷ��Ӿ���ĸߣ����Ӿ����۵��ɾ�������Դ�С�����������ܣ�AlF3��GaF3�������۷е㣺AlF3��GaF3��AlCl3���ʴ�Ϊ��AlF3��GaF3Ϊ���Ӿ��壬AlCl3Ϊ���Ӿ��壬�����ܣ�AlF3��GaF3��
������ʱAlCl3���ɿɻӷ��Ķ�����Al2Cl6���ö�������Al�ṩ�չ����Clԭ���ṩ���Ӷ��γ���λ������ṹʽΪ ��������е���λ����ֱָ��ͬ��������(��ԭ��)��λ��ԭ����Ŀ��������Al2Cl6����Alֱ��������ԭ����4����������λ��Ϊ4���ʴ�Ϊ��
��������е���λ����ֱָ��ͬ��������(��ԭ��)��λ��ԭ����Ŀ��������Al2Cl6����Alֱ��������ԭ����4����������λ��Ϊ4���ʴ�Ϊ�� ��4��
��4��
(4)���ڵ�����Asԭ�ӵľ���Ϊ���㵽���ĵľ���x=![]() apm�����ڵ�As��Gaԭ��֮��ľ���Ϊy=
apm�����ڵ�As��Gaԭ��֮��ľ���Ϊy=![]() ��
��![]() apm����x��y=
apm����x��y=![]() apm��(
apm��(![]() ��
��![]() apm)=
apm)=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£�
N2(g)+O2(g)![]() 2NO(g)����H>0����֪�÷�Ӧ��240����ƽ�ⳣ��K=64��10-4����ش�
2NO(g)����H>0����֪�÷�Ӧ��240����ƽ�ⳣ��K=64��10-4����ش�
(1)ij�¶��£���2L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol����N2�ķ�Ӧ����Ϊ______��
(2)�ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־______��
A.����1molN2ͬʱ����1molO2![]() ��������ܶȲ���
��������ܶȲ���
C.�������ƽ����Է�����������D.2v��(N2)=v��(NO)
(3)��N2��O2�Ļ�����������º����ܱ������У���ͼ�仯������ȷ����______(����ĸ���)��

(4)����º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬![]() ��ԭƽ��״̬��ȣ���ʱƽ��������NO���������______
��ԭƽ��״̬��ȣ���ʱƽ��������NO���������______![]() ���������������С������������
���������������������������![]()
(5)���¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1mol/L��4.0��10-2mol/L��3.0��10-3mol/L����ʱ��Ӧ______(�������ڻ�ѧƽ��״̬������������Ӧ����������������淴Ӧ���������)��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.1mol��L��1NaOH��Һ�ζ�20mL0.1mol��L��1CH3COOH(Ka=1.75��10��5)��Һ�Ĺ����У�����NaOH��Һ���������ҺpH�Ĺ�ϵ��ͼ��ʾ�����и���������Ũ�ȹ�ϵ��ȷ����
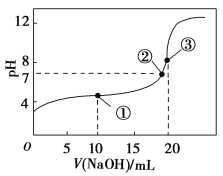
A.�����ʾ��Һ�У�2c(CH3COO��)��2c(CH3COOH)=c(H��)��c(OH��)
B.������ʾ��Һ�У�c(Na��)>c(CH3COO��)>c(OH��)>c(H��)
C.������ʾ��Һ�У�c(CH3COO��)��C(CH3COOH)=c(Na��)��2c(H��)��2c(OH��)
D.pH=12����Һ�У�c(Na��)>c(CH3COO��)>c(H��)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ �����н�����ȷ����( )
�����н�����ȷ����( )
A. ���л������ʽΪC13H16 B. ���л������ڱ���ͬϵ��
C. ���л������������4��̼ԭ�ӹ�ֱ�� D. ���л�����������13��̼ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУѧ������ͼ��ʾװ�ý���ʵ�顣��̽�������巢����Ӧ��ԭ���������ᴿ��Ӧ�IJ��

��ش��������⣺
(1)д��װ�â��з�������Ҫ��ѧ��Ӧ����ʽ____________________________���������������������Ϊ������________���������θ���ܵ�������__________��
(2)ʵ�鿪ʼʱ���ر�K2������K1�ͷ�Һ©���������μӱ���Һ��Ļ��Һ����Ӧ��ʼ������С�Թ��ڱ���������_________________________��
(3)��˵������Һ�巢����ȡ����Ӧ��������______________________��
(4)��Ӧ������Ҫ��װ�â��е�ˮ������װ�â����Գ�ȥװ�â��в����HBr���塣�������ʵ����һ������______________________________________��
(5)�������屽����ɫ��״��Һ�壬���װ���Ƶõ��屽�ʺ���ɫ��ԭ�����������______________����������ƿ�ڷ�Ӧ���Һ�����ν�������ʵ������Ϳɵõ��ϴ������屽����������ˮϴ�ӣ�����Һ������__________ϴ�ӣ�����Һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���һ�����ܱ������У��ܱ�ʾ��Ӧ X(g)+2Y(g)![]() 2Z(g) һ���ﵽ��ѧƽ��״̬����( )
2Z(g) һ���ﵽ��ѧƽ��״̬����( )
��������������ܶȲ��ٷ����仯 �� X��Y��Z��Ũ�Ȳ��ٷ����仯 �������е�ѹǿ���ٷ����仯 �ܵ�λʱ��������n mol Z��ͬʱ����2n mol Y
A.�٢�B.�ڢ�C.�ۢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴ӦM(g)��N(g) ![]() P (g)��Q(g) ����ش��������⣺
P (g)��Q(g) ����ش��������⣺
(1)��ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊ��c(M)= 1 molL-1��c(N)=2.4 molL-1���ﵽƽ���M��ת����Ϊ60������ʱN��ת����Ϊ__________ �����¶�ʱK=_________��
(2)���¶�����Kֵ������÷�ӦΪ______��Ӧ��������ȡ����ȡ���������_________________��
(3)����Ӧ�¶����ߣ�M��ת����______���������С�����䡱����
(4)����Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊ��c(M)= 4molL-1, c(N)=a molL-1;�ﵽƽ���c(P)=2 molL-1,a=________��
(5)����Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ��Ϊ��c(M) = c(N)= b molL-1���ﵽƽ���M��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£������pH����ͬ��������Ȼ����Һ��ˮϡ��ʱ��pH�仯������ͼ��ʾ�������ж���ȷ����
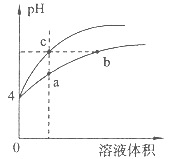
A. a��c������Һ�ĵ���������ͬ
B. b����Һ��c(H+)+c(NH3��H2O)=c(OH-)
C. a��b��c������Һ��ˮ�ĵ���̶�a>b>c
D. �õ�Ũ��NaOH��Һ�͵����b��c����Һ��Ӧ������NaOH��Һ���Vb=Vc
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. CH4(g)��2O2(g)=CO2(g)��2H2O(g)����H����801.3kJ/mol ���ۣ�CH4��ȼ����Ϊ801.3kJ/mol
B. Sn(s����) ![]() Sn(s����)����H����2.1kJ/mol(����Ϊ��ĩ״)���ۣ�����Ʒ�ں���Ķ�������ת��Ϊ��������
Sn(s����)����H����2.1kJ/mol(����Ϊ��ĩ״)���ۣ�����Ʒ�ں���Ķ�������ת��Ϊ��������
C. ϡ��Һ���У�H��(aq)��OH��(aq)=H2O(l)����H����57.3kJ/mol���ۣ��������백ˮ��ϡ��Һ��Ϻ�������1mol H2O�����ų�57.3kJ������
D. C(s��ʯī)��O2(g)=CO2(g)����H����393.5kJ��mol��1C(s�����ʯ)��O2(g)=CO2(g)����H����395kJ��mol��1 ���ۣ���ͬ�����½��ʯ���ʱ�ʯī�ȶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com