
【题目】甲、乙两烧杯中盛有物质的量浓度相等的盐酸、氢氧化钠溶液各1 L,分别向其中加入等质量的铝片,反应完全后,甲中产生H2的体积为2.24 L,乙中产生H2的体积为3.36 L(气体体积均在标准状况下测定),则下列判断正确的是
A. 甲、乙中铝都有剩余
B. 铝片的质量是1.8 g
C. 盐酸或氢氧化钠的物质的量浓度为0.1 mol/L
D. 盐酸或氢氧化钠的物质的量浓度为0.2 mol/L
【答案】D
【解析】盐酸和氢氧化钠溶液中溶质的物质的量相等,两烧杯中分别加入铝粉,反应结束后测得生成的气体体积比为甲:乙=2:3,比值处于1:3和1:1之间,由于铝消耗酸量大于碱,此时铝对于酸过量而对于碱不足;
铝与酸反应时酸完全反应,生成的氢气的物质的量为0.1mol,
则 2Al+6HCl═2AlCl3+3H2↑
2 6 3
![]() 0.2 0.1
0.2 0.1
消耗Al的质量是![]() mol×27g/mol=1.8g,
mol×27g/mol=1.8g,
碱与金属铝反应时铝完全反应,生成的氢气的物质的量为0.15mol,
则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 2 3
0.1 0.1 0.15mol
则Al的质量为0.1mol×27g/mol=2.7g,
A、甲中铝有剩余,选项A错误; B、甲、乙中消耗铝的质量分别是1.8g、2.7g,铝对于酸过量而对于碱不足,铝片的质量应大于2.7g,选项B错误;C、铝对于酸过量而对于碱不足,所以盐酸或氢氧化钠的物质的量浓度为![]() =0.2 mol/L,选项C错误;D、盐酸或氢氧化钠的物质的量浓度为
=0.2 mol/L,选项C错误;D、盐酸或氢氧化钠的物质的量浓度为![]() =0.2 mol/L,选项D正确。答案选D。
=0.2 mol/L,选项D正确。答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 能自发进行的反应都是放热反应
B. 凡是熵增加的反应一定能自发进行
C. 在一定条件下,吸热反应可以自发进行
D. 放热的熵增加的反应不一定能够自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3反应的化学方程式:_________________________________________。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO![]() +4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
+4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①____SeO2+____I-+____H+===____Se+____I2+____H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程式①,并标出电子转移的方向和数目。_____________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测样品中SeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 铝与烧碱溶液反应铝作还原剂 B. 在硫酸铁溶液中滴加硫氰化钾溶液,溶液变红
C. 可用 Al2O3 制成的坩埚熔融烧碱 D. 明矾溶于水能形成胶体,可用其净化生活用水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g) + F(s) ![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:

①b<f
②915 ℃、2.0 MPa时E的转化率为60%
③该反应的ΔS>0
④K(1 000 ℃)>K(810 ℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向某浓度的新制氯水中逐滴加入Na2SO3溶液,溶液pH 变化如图所示(整个过程中无气体逸出),下列关系正确的是( )

A. a点:c(H+)=c(Cl-)+c(OH-)
B. b点:c(Cl-)=0.005mol·L-1
C. c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)+2c(H2SO3)
D. d 点:c(Na+)>c(Cl-)>2c(SO32-)+c(HSO3-)+2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可用作净水剂、除草剂等。某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2,不考虑其它杂质)的含量并制备了绿矾,其流程如下:

(1)溶液A中含有的主要阴离子除OH-外还有____________________。
(2)试剂C是__________。
(3)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是________________。
(4)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。绿矾还原沉淀法是常用的一种方法:

①已知2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
②还原一步的离子方程式是___________________________;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象的预测或装置的选用正确的是
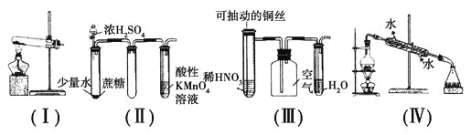
A.用装置(Ⅰ)加热草酸晶体获取某些气体(草酸晶体的熔点101.5 ℃,分解温度约为150 ℃)
B.用装置(Ⅱ)进行实验时,酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.用装置(Ⅲ)进行实验时,广口瓶内先有浅红棕色气体出现后又变为无色,且不会产生空气污染
D.用装置(Ⅳ)分离溴苯和苯的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
A. 16O和18O是同一种核素 B. 1H218O的摩尔质量为20
C. 34S和15N核内的中子数相差9 D. 2H+核外电子数为0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com