
【题目】在一定条件下,可逆反应:N2(g)+3H2(g)![]() 2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是 ( )
2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是 ( )
A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等
B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数
C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数
D.加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】海水酸化将改变海水化学的种种平衡,使依赖于化学环境稳定性的多种海洋生物乃至生态系统面临巨 大威胁.用生石灰中和法阻止海水酸化是人们的一种设想.生石灰属于( )
A.酸
B.碱
C.盐
D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氢键的说法正确的是
A.氢键是一种比较弱的化学键
B.HF的稳定性很强,是因为其分子间能形成氢键
C.乙醇分子与水分子之间形成氢键,使乙醇能与水任意比互溶
D.碘化氢的沸点比氯化氢的沸点高是因为碘化氢分子之间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的基本操作中,正确的是( )
A.用同一个滴管取用不同的药品
B.将实验中剩余的药品放回原试剂瓶
C.实验前对实验装置进行气密性检查
D.将实验室制备的可燃性气体直接点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
![]()
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
② 用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③ 步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因____________。
④ NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
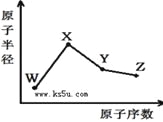
A. 最高化合价X>Y>Z>W
B. 气态氢化物的稳定性Z>Y>W
C. Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应
D. X、Z、W三种元素形成的化合物一定既含离子键又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元
素的含量。实验步骤如下:
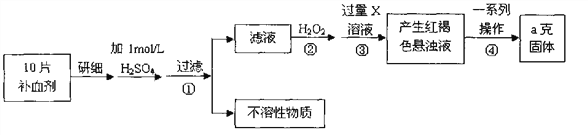
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法________________________________,该
过程的现象为:______________________________
(2)步骤②加入过量H2O2的目的(用离子方程式表示):_______________。
(3)步骤③中反应的离子方程式:_______________________________________。
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的
氧化还原反应为(用化学方程式表达)_________________________。
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:_________、
洗涤、_________、冷却、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量__________g。
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂
来补充铁,则正常人每天服需用含______________mgFeSO4·7H2O的片剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com