
【题目】加碘盐的主要成分是NaCl,还添加了适量的KIO3。下列说法中正确的是 ( )
A. KIO3和NaCl为离子化合物,均只含离子键
B. KIO3中阳离子的结构示意图为![]()
C. 23Na37Cl中质子数和中子数之比是8∶7
D. 次碘酸的结构式为H—O—I
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1mol 羟基所含的电子数为7NA
B.9.2 克甲苯含有的C﹣H 数目为0.8NA
C.28g 聚乙烯含有的碳原子数为2nNA
D.1mol 乙醇催化氧化生成乙醛时转移的电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式: .
(2)H3PO2中,磷元素的化合价为 .
(3)NaH2PO2是正盐还是酸式盐?其溶液显性(填弱酸性、中性、或者弱碱性).
(4)H3PO2也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过):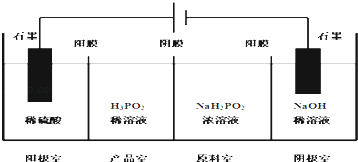
①写出阴极的电极反应式 .
②分析产品室可得到H3PO2的原因 .
③早期采用“三室电渗析法”制备H3PO2 , 将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是杂质.该杂质产生的原因是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磁性流体材料广泛应用于减震、医疗器械、声音调节等高科技领域。下图是制备纳米Fe3O4磁流体的两种流程:

(1)分析流程图中的两种流程,其中______(填“流程1”、“流程2”)所有反应不涉及氧化还原反应。步骤①反应的离子方程式为____________。
(2)步骤②保持50℃ 的方法是_____________。
(3)步骤③中加入的H2O2电子式是_______,步骤③制备Fe3O4磁流体的化学方程式为_______。
(4)流程2中FeCl3和FeCl2制备Fe3O4磁流体,理论上FeCl3和FeCl2物质的量之比为_____。己知沉淀B为四氧化三铁.步骤⑤中操作a具体的步骤是____________。
(5)利用K2Cr2O7可测定Fe3O4磁流体中的Fe2+含量。若Fe3O4磁流体与K2Cr2O7充分反应消耗了0.01mol·L -1的K2Cr2O7标准溶液100mL,则磁流体中含有Fe2+的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系。
(1)若A为金属铝,B为氧化铁,该反应的一种用途是_______________。
(2)若A是一种能使紫色石蕊试液变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为____________________________。
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的离子反应方程式为__________。
(4)若A是一种酸式盐,可作为食品制作过程中的膨松剂,A、B、D溶于水时均呈碱性,则该反应的离子反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的CO和N2,下列说法中:①它们所含原子个数相等;②它们所含分子数相等;③它们的质量相等。正确的有
A. ①② B. ①③ C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为_________,价层电子的轨道表达式为_________。
(2)Ni的两种配合物结构如图所示:
A B
①A 的熔、沸点高于B的原因为_________。
②A晶体含有化学键的类型为___________(填选项字母)。
A.σ键 B.π键 C.配位键 D.金属键
③A晶体中N原子的杂化形式是_________。
(3) 人工合成的砷化镍常存在各种缺陷,某缺陷砷化镍的组成为Ni1.2As, 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为_________。
(4) NiAs的晶胞结构如图所示:

①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为_________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com