
【题目】“雾霾”“PM2.5”已成为电视、新闻热词,下列做法不符合“环境友好”的是( )
A.使用清洁能源,减少煤的燃烧
B.减轻交通压力,提倡私家车出行
C.道路、建筑工地定期喷洒水,减少扬尘
D.种植沙漠防护林,减少沙尘暴
科目:高中化学 来源: 题型:
【题目】Ⅰ、某化学活动小组利用如下甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有饱和KCl溶液的琼脂)

(1)在甲图装置中,当电流计中指针发生偏转时,盐桥中的离子移动方向为:K+移向_____烧杯(填“A”或“B”),装置中电子的移动路径和方向为___________________________。
Ⅱ、该小组同学提出设想:如果将实验中的盐桥换为导线(铜制),电流表是否也发生偏转呢?带着疑问,该小组利用图乙装置进行了实验,发现电流计指针同样发生偏转。回答下列问题:
(2)该小组的一位成员认为溶液中的阴阳离子能通过铜导线从而构成闭合回路形成电流,该装置仍然为原电池。你对该观点的评价是_________(填“正确”或“不正确”)。
(3)对于实验中产生电流的原因,该小组进行了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯A实际为原电池。那么在烧杯B中铜片上发生反应的电极反应式为______________________。
(4)对于图乙烧杯A实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu做电极,H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的正极反应式为:_________________________________。
②另一部分同学认为是溶液酸性较弱,由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的正极反应式为:_________________ 。
(5)若第(4)问中②观点正确,则可以利用此原理设计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,请写出该电池工作时总反应的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一镁铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量与加入氢氧化钠的体积关系如图所示,原合金中镁铝的质量比为
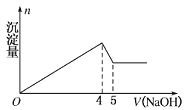
A. 4:9 B. 4:3 C. 8:9 D. 20:27
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分)=气体总压(P总)×体积分数,下列说法正确的是( ) 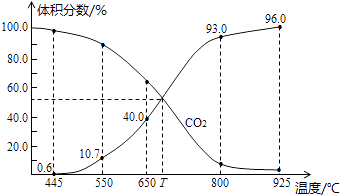
A.550℃时,若充入惰性气体,v正 , v退均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_____ (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ ,反应的离子方程式为____ __。
(3)实验室溶解该熔融物,下列试剂中最好的是___ ___(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
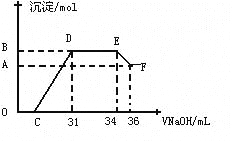
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____ __
(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ _ ,上述现象说明溶液中_____ _结合OH—的能力比___ ___强(填离子符号)。
(6)B点对应的沉淀的物质的量为____ __mol,C点对应的氢氧化钠溶液的体积为____ __mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室制取CO2气体的过程中,不慎用到了浓盐酸,导致制得的CO2气体中混有HCl气体,他们设计了如下除去HCl气体并探究CO2与过氧化钠(Na2O2)反应的实验。请回答下列问题:
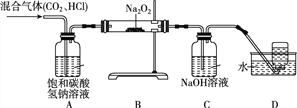
(1)装置A的作用是___________________________。
(2)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含________,该小组同学继续进行探究。
【提出问题】反应后硬质玻璃管中固体的成分是什么?
(3)【做出猜想】猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH
经过讨论,大家一致认为猜想二不合理,理由是_____________________________(用化学反应方程式表示)。
(4)【实验验证】小组同学取上述形成的溶液M于试管中,向其中加入过量的____________________溶液,若产生白色沉淀,过滤,向滤液中滴加几滴酚酞试液,溶液变红,则证明猜想三成立。
(5)【交流反思】小组中有同学认为,将上述滤液中滴加的酚酞试液换成硝酸铜溶液,也能得出同样的结论,你认为该同学的观点_____________(填“正确”或“错误”),理由是:____________________________________________(用化学反应方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为S+2KNO3+3C===K2S+N2↑+3CO2↑。该反应中还原剂是( )
A. C B. KNO3 C. S D. N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+ 物质的量浓度最大的是( )
A. 4 L 0.5 mol/L NaCl溶液 B. 5 L 0.4 mol/L NaOH溶液
C. 2 L 0.15 mol/L Na3PO4溶液 D. 1 L 0.3 mol/L Na2SO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com