
����Ŀ������ij��ѧ�С���������¼�װ�ö�ԭ��ؽ����о�����ش��������⣺����������Ϊ���б���KCl��Һ����֬��

��1���ڼ�ͼװ���У�����������ָ�뷢��ƫתʱ�������е������ƶ�����Ϊ��K+����_____�ձ�������A������B������װ���е��ӵ��ƶ�·���ͷ���Ϊ___________________________��
������С��ͬѧ������룺�����ʵ���е����Ż�Ϊ���ߣ�ͭ�ƣ����������Ƿ�Ҳ����ƫת�أ��������ʣ���С������ͼ��װ�ý�����ʵ�飬���ֵ�����ָ��ͬ������ƫת���ش��������⣺
��2����С���һλ��Ա��Ϊ��Һ�е�����������ͨ��ͭ���ߴӶ����ɱպϻ�·�γɵ�������װ����ȻΪԭ��ء���Ըù۵��������_________��������ȷ����������ȷ������
��3������ʵ���в���������ԭ��С�����������̽�֣�����ʦ����ע�ʹ�õ���ͭ���ߣ��ձ�Aʵ��Ϊԭ��ء���ô���ձ�B��ͭƬ�Ϸ�����Ӧ�ĵ缫��ӦʽΪ______________________��
��4������ͼ���ձ�Aʵ����ԭ��ص������ϣ���С���Ա�����˺ܴ���磺
��һ����ͬѧ��Ϊ������ZnSO4��Һˮ�������ԣ���ʱԭ���ʵ������Zn��Cu���缫��H2SO4��Һ��Ϊ�������Һ�����ɵ�ԭ��ء��������۵���ȷ����ôԭ��ص�������ӦʽΪ��_________________________________��
����һ����ͬѧ��Ϊ����Һ���Խ����������ܽ�����Һ�е����������ã�ʹ��Zn��Cu֮���γ�ԭ��ء��������۵���ȷ����ôԭ��ص�������ӦʽΪ��_________________ ��
��5�����ڣ�4�����Тڹ۵���ȷ����������ô�ԭ����Ƶ��Ϊ��ƫԶ���������ĵ������硣�����װ��Ϊ�Խ�������ʯīΪ�缫���Ժ�ˮΪ�������Һ����д���õ�ع���ʱ�ܷ�Ӧ�Ļ�ѧ����ʽ_____________________________________��
���𰸡� B ��Zn�缫�ص�������Cu�缫 ����ȷ Cu2++2e-=Cu 2H++2e-=H2�� O2+4e-+2H2O=4OH- 4Al+3O2+6H2O=4Al(OH)3
����������1���ڼ�ͼװ���У���������ָ�뷢��ƫתʱ���γ�ԭ��أ�пΪ���ý�������������ʧȥ���ӣ�ͭΪԭ��������������ϵõ��Ӷ�����ԭ��ԭ����У������ɸ��������·�����������������Һ�У��������������ƶ������������ƶ�����K+����B�ձ���װ���е�����Zn�缫�ص�������Cu�缫����2����������Ż��ɵ��ߣ�ͭ�ƣ�������ͼ������С��ͬѧ���ֵ�����ָ����Ȼ����ƫת����A�п��Թ���ԭ��أ�пΪ���ý�������������ʧȥ���ӣ�ͭΪԭ��������������ϵõ��Ӷ�����ԭ��B��ͭ��ʯī�ֱ����ӵ�Դ����������������ӦΪCu2++2e-=Cu��������ӦΪCu-2e-=Cu2+��BΪ������װ�ã��ʸ�С��ͬѧ����Ĺ۵㲻��ȷ����3���ձ�Aʵ��Ϊԭ��أ��ձ�B��ͭƬ����������������Ӧ�ĵ缫��ӦʽΪ��Cu2++2e-=Cu����4������Zn��Cu���缫��H2SO4��Һ��Ϊ�������Һ�����ɵ�ԭ��أ����������ӵõ��Ӳ����������缫��ӦʽΪ��2H++2e-=H2����������Һ���Խ����������ܽ�����Һ�е����������ã�ʹ��Zn��Cu֮���γ�ԭ��أ������������õ��Ӳ������������ӣ��缫��ӦʽΪ��O2+4e-+2H2O=4OH-����5���Խ�������ʯīΪ�缫���Ժ�ˮΪ�������Һ��AlΪ������������Ӧ���缫��ӦΪAl-3e-+3OH-=Al(OH)3��������ӦΪ O2+4e-+2H2O=4OH-���õ�ع���ʱ�ܷ�Ӧ�Ļ�ѧ����ʽΪ4Al+3O2+6H2O=4Al(OH)3��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.���������ںϳ�ҩ��B.SO2������Ⱦ��ҵ������û�м�ֵ
C.��������ֽ��ҵ��������Ҫ��Ӧ��D.����ͭ����Ӿ�س�ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ���ǣ� ��
A.һ��Ũ�ȵĴ�������Һ��ʹ��̪��Һ��죬��ԭ���Ƿ��������·�Ӧ��CH3COO��+H2OCH3COOH+OH�� �� ʹ����Һ�е�c��OH������c��H+��
B.�ڳ����£�10 mL 0.2 molL��1������10 mL 0.2 molL��1 Ba��OH��2��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ20 mL������Һ��pH=13
C.��0.1 molL��1 NH4Cl��Һ�У�c��H+��+c��NH4+=c��Cl����
D.5 mL 1 molL��1 CH3COONa��Һ��5 mL 1 molL��1������Һ��c��Cl����=c��Na+����c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�и�����Ũ�ȹ�ϵ��ȷ���ǣ� ��
A.pH��ȵĢ�NH4Cl��Һ���ڣ�NH4��2SO4��Һ����NH4HSO4��Һ����Һ��c��NH4+���Ĵ�С˳��Ϊ�٣��ڣ���
B.pH��ȵ�NaF��Һ��CH3COOK��Һ��[c��Na+����c��F����]��[c��K+����c��CH3COO����]
C.0.2 mol?L��1Na2CO3��Һ��c��OH����=c��HCO![]() ��+c��H+��+c��H2CO3��
��+c��H+��+c��H2CO3��
D.0.2 mol?L��1������0.1 mol?L��1NaAlO2��Һ�������ϣ�c��Cl������c��Na+����c��Al3+����c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��Cu2+��aq��+Fe��s���TFe2+��aq��+Cu��s����Ƶ�ԭ�����ͼ��ʾ��
��ش��������⣺
��1���������ҺY����
��2��Cu�缫�����ĵ缫��ӦΪX�缫�Ϸ����ĵ缫��ӦΪ��
��3�����·�еĵ����Ǵ��缫�����缫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe(OH)3������Ʊ�ʵ�飺��_____________����μ���______________________��Һ�������������Һ��______________ɫ��ֹͣ���ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ͭ��Ҫȡ�Ի�ͭ��(CuFeS2)��ʪ����ͭ���յĺ����ǻ�ͭ��Ľ�����Ŀǰ��Ҫ��������������λ����������������ַ�����
I����������
��1���������������˫��ˮ����ͭ�������������SO42-���ɡ�
�ٸ÷�Ӧ�����ӷ���ʽΪ________________________________.
�ڸ÷�Ӧ��25��50���½��У�ʵ��������˫��ˮ��������ҪԶԶ��������ֵ���Է�����ԭ��Ϊ__________________________________________________
���������
��Ӧԭ��Ϊ��CuFeS2��NH3��H2O��O2��OH���� Cu(NH3)42����Fe2O3��SO42����H2O(δ��ƽ)
��2���û�ѧ������Ͱ�ˮ��Һ�������______________________________.
��3��������Ϊ���ȶ���Һ��pH�������ڽ���Һ����___________________���������ƣ���.�������
�ڷ�Ӧ���м����ͭ�������������������������������ͭ�����ܽ⣬��Ӧ���и����ʵ�ת����ϵ��ͼ��ʾ��
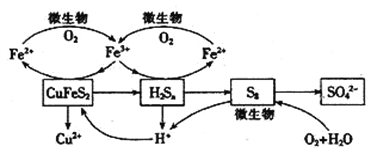
��4��������������£�����ѭ��ʹ�õ�������_________���ѧʽ���������������ӷ�Ӧ����ʽΪ_______________________________����дһ������
��5�������ͭ���е���Ԫ������ȫ��ת��ΪFe3+������2 mol SO42-����ʱ������������O2�����ʵ���Ϊ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ��������ˮ��Cl2+H2O==2H++Cl-+ClO-
B. ����HI��Һ���뵽Fe(NO3)3��Һ�У�2Fe3++2I-=2Fe2++I2
C. ������Һ��KBrO3��KBr��Ӧ����Br2��BrO3-+Br-+6H+=Br2+3H2O
D. NaHCO3��Һ�м�����Ba(OH)2��Һ��HCO3-+ Ba2++OH-=BaCO3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������PM2.5���ѳ�Ϊ���ӡ������ȴʣ��������������ϡ������Ѻá����ǣ� ��
A.ʹ�������Դ������ú��ȼ��
B.���ύͨѹ�����ᳫ˽�ҳ�����
C.��·���������ض�������ˮ�������ﳾ
D.��ֲɳĮ�����֣�����ɳ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com