
【题目】HA 为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如图所示。向10 mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列说法中,不正确的是

A. pH=9时,c(A-)=c(HA)
B. x=0时,1
C. HA的电离平衡常数ka=10-5
D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可制取有广泛用途的Na2FeO4:Fe+2H2O+ 2NaOH![]() Na2FeO4+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。下列说法不正确的是
Na2FeO4+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。下列说法不正确的是

A. a是电源的正极
B. 电解一段时间后,c(OH-)降低的区域在阴极室
C. 电解过程中,阳极发生的电极方程式为Fe+8OH--6e-==FeO42-+4H2O
D. 如图2,N点c(Na2FeO4)低于最高值的原因是氢氧化钠溶液浓度过高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列八种物质: ①铝 ②蔗糖 ③SiO2 ④H2SO4 ⑤NaOH ⑥FeSO4溶液 ⑦Ba(OH)2 ⑧氢氧化铁胶体。
(1)上述物质属于电解质的有____________(填序号,下同),能导电的有__________。
(2)上述物质中有两种物质在水溶液中反应的离子方程式为H++OH===H2O,则该反应的化学方程式为____________。
(3)实验室制备⑧的离子方程式为__________________。若在⑧中缓慢加入④的溶液,产生的现象是________________________。
(4)③是玻璃的主要成分之一,③与⑤溶液反应的化学方程式为_______________。工艺师常用_______(填物质名称)来雕刻玻璃。
Ⅱ.下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A.分液 B.过滤 C.萃取 D.蒸馏 E.蒸发结晶 F.高温分解
(1)分离CCl4和H2O:___________。
(2)除去澄清石灰水中悬浮的CaCO3: ___________。
(3)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与颜色有关的描述中不正确的是
A. 铜在氯气中燃烧产生棕黄色烟
B. FeCl3溶液中加入KSCN溶液产生血红色沉淀
C. 将Cl2通人石蕊溶液,石蕊溶液先变红后褪色
D. 氢气在氯气中燃烧,产生苍白色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:
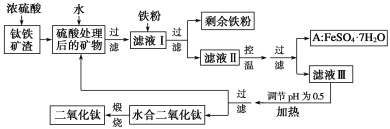
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是______________________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________、_______________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:_________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_____________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、______(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56a kg A(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36b kg A和1.12c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料__________ kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做了如下实验:
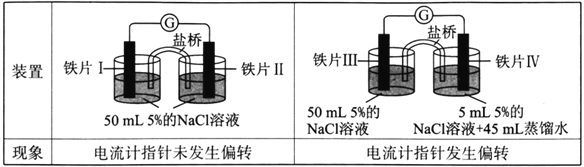
下列说法中正确的是
A. 加热铁片I所在烧杯,电流表指针会发生偏转
B. 用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极
C. 铁片I、Ⅲ的腐蚀速率相等
D. “电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:
(1)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨.
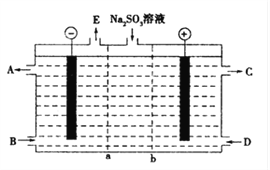
①a表示____离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示______.E表示_______.
②阳极的电极反应式为___________________________________.
(2)Na2SO3溶液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO3﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
①Na2SO3溶液显______性,理由(请用离子方程式表示)_______________________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ____
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
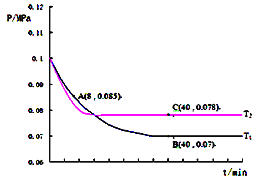
①图中A点时,SO2的转化率为________.
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,C点的正反应速率vc(正)与A点的逆反应速率vA (逆)的大小关系为vc(正)_____vA (逆)(填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=__________(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
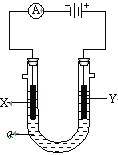
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中X极现象为__________________________,电极反应式为___________________ 。
②如要用电解方法精炼粗铜,电解液a选用_________溶液,则Y电极的材料是________ 。
③如要在铁上镀银,电解液选用硝酸银,则X电极的材料是_________,电极反应式是_________________。
(2)下图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2=2Fe(OH)2。Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈。请根据图示,回答下列问题:

在上述电化学腐蚀中,碳(C)作_______极,写出负极的电极反应式_________________。如果将长期浸泡在河水中的钢铁闸门与外加电源连接防腐,应将闸门连接外部直流电源的_______极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com