
【题目】(1)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
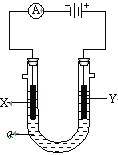
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中X极现象为__________________________,电极反应式为___________________ 。
②如要用电解方法精炼粗铜,电解液a选用_________溶液,则Y电极的材料是________ 。
③如要在铁上镀银,电解液选用硝酸银,则X电极的材料是_________,电极反应式是_________________。
(2)下图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2=2Fe(OH)2。Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈。请根据图示,回答下列问题:

在上述电化学腐蚀中,碳(C)作_______极,写出负极的电极反应式_________________。如果将长期浸泡在河水中的钢铁闸门与外加电源连接防腐,应将闸门连接外部直流电源的_______极。
【答案】 产生无色气泡 ,溶液变红色 2 H++2e—=H2↑ CuSO4(可溶性铜盐溶液) 粗铜 铁 Ag+ + e—=Ag 正 Fe-2e-= Fe2+ 负
【解析】(1). ①. 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,由装置图可知,X极连接外加电源的负极,则X为阴极,电极反应式为:2H++2e-= H2↑,X极有无色气泡产生,X极附近溶液碱性增强,溶液变红色,故答案为:产生无色气泡 ,溶液变红色;2H++2e-= H2↑;
②. 如要用电解方法精炼粗铜,电解液a应选用CuSO4(可溶性铜盐溶液),Y为阳极,则Y电极材料为粗铜,故答案为:CuSO4(可溶性铜盐溶液);粗铜;
③. 如要在铁上镀银,电解液选用硝酸银溶液,待镀金属作阴极,镀层金属作阳极,因X电极为阴极,则X电极的材料是铁,银离子在阴极得电子生成单质银,电极反应式为Ag+ + e-=Ag,故答案为:铁;Ag+ + e-=Ag;
(2). 据图可知,钢铁在潮湿空气中发生电化学腐蚀时,氧气在碳电极得电子发生还原反应,则碳为正极,在负极上,铁失电子生成亚铁离子,电极反应式为Fe-2e-= Fe2+,金属在电解池中作阴极时受保护,如果将长期浸泡在河水中的钢铁闸门与外加电源连接防腐,应将闸门连接直流电源的负极,故答案为:正;Fe-2e-= Fe2+;负。


科目:高中化学 来源: 题型:
【题目】HA 为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如图所示。向10 mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列说法中,不正确的是

A. pH=9时,c(A-)=c(HA)
B. x=0时,1
C. HA的电离平衡常数ka=10-5
D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学药品有特定的保存方式,下列叙述不正确的是
A. 钠保存在细口瓶中并加煤油液封
B. 新制氯水保存在棕色瓶中并置于冷暗处
C. NaOH溶液保存在无色试剂瓶中并要塞紧橡胶塞
D. 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4v正(O2)=5v逆(NO)
B. 若单位时间内生成xmol NO的同时,消耗xmolNH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述或操作正确的是
A. 浓硫酸具有强氧化性,稀硫酸无氧化性
B. 浓硫酸不慎沾到皮肤上,应立即用水冲洗
C. 稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌
D. 浓硫酸与铜的反应中,浓硫酸仅表现强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,发生反应2A+B=2C+D,若最初A、B都是8mol,在前10s 内A 的平均速率为0.24mol(Ls)-1,则10s时B的物质的量是
A.2.4molB.3.2molC.4.8molD.5.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程中,不仅有物质的变化,同时还伴有能量的变化。
(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,回答下列有关中和反应反应热的问题。
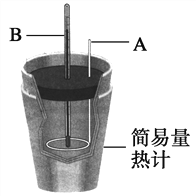
①用0.1 mol H2SO4配成稀溶液与稍过量NaOH反应,能放出________ kJ热量。本实验中用稍过量的NaOH的原因是_____________
②上图装置中仪器A的名称是_____,作用是______________________;
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的ΔH_____________(填“偏大”、“偏小”或“无影响”)。
(2)已知:拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是a kJ、b kJ、c kJ,则N2(g) + 3H2(g)=2NH3(g) △H=_______kJ/mol。(用a、b、c表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4=Fe2O3+SO2↑+SO3↑。如将生成的混合气体通过足量Ba(NO3)2溶液,应发生的现象有( )
A.产生的沉淀只有BaSO4和BaSO3B.产生的沉淀只有BaSO4
C.一定有SO2逸出D.一定有SO3逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com