
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
分析 该反应中S元素化合价由-2价、+4价变为0价,所以二氧化硫是氧化剂、硫化氢是还原剂,还原剂对应的产物是氧化产物、氧化剂对应的产物是氧化产物,根据还原剂和氧化剂的物质的量之比确定氧化产物和还原产物物质的量之比.
解答 解:该反应中S元素化合价由-2价、+4价变为0价,所以二氧化硫是氧化剂、硫化氢是还原剂,还原剂对应的产物是氧化产物、氧化剂对应的产物是氧化产物,还原剂和氧化剂的物质的量之比是2:1,根据原子守恒知,氧化产物和还原产物的物质的量之比是2:1,故选B.
点评 本题考查氧化还原反应,侧重考查基本概念及基本计算,明确元素化合价变化是解本题关键,熟悉常见元素化合价,题目难度不大.


科目:高中化学 来源: 题型:解答题
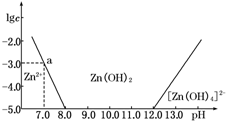 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:| c(HCl) | |||||||
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) | |||||||
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH(l) | CO(g) | CH3COOH(l) |
| △H/kJ•mol-1 | -727 | -283 | -875 |
| A. | -135kJ/mol | B. | -331kJ/mol | C. | +135kJ/mol | D. | +148kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
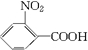 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
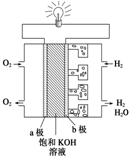 I:能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能,大自然利用这一能源最成功的是植物的光合作用.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.
I:能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能,大自然利用这一能源最成功的是植物的光合作用.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
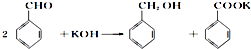
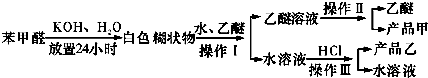
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
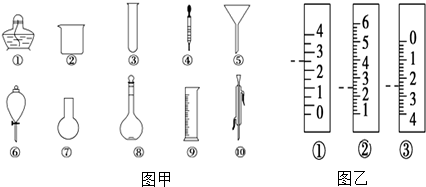
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成了氢氧化铁沉淀 | |
| B. | 体系中存在着氢氧化铁的沉淀溶解平衡 | |
| C. | 溶液中不再存在Fe3+ | |
| D. | 加入少量盐酸,则溶液中Fe3+浓度会上升 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com