
ΓΨΧβΡΩΓΩΑΔ±»ΕδΕϊΡή”––ß“÷÷Τ–¬–ΆΙΎΉ¥≤ΓΕΨΘ§Μ·ΚœΈο G «Κœ≥…ΑΔ±»ΕδΕϊΒΡ÷–ΦδΧεΘ§ΤδΚœ≥…¬ΖœΏ»γœ¬ΘΚ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©AΒΡΜ·―ßΟϊ≥ΤΈΣ_____ΘΜB ΒΡΫαΙΙΦρ ΫΈΣ_____ΓΘ
Θ®2Θ©”… B ΒΫC ΒΡΖ¥”Πάύ–ΆΖ÷±πΈΣ________________ΓΘ
Θ®3Θ©‘ΎΚœ≥…Μ·ΚœΈοGΒΡΝς≥Χ÷–Θ§”…AΒΫBΒΡΡΩΒΡ «________________________ΓΘ
Θ®4Θ©±ΫΝρΖ”ΒΡ–‘÷ ”κ±ΫΖ”œύΥΤΘ§±ΫΝρΖ”ΒΡΙΌΡήΆ≈ΈΣ_____Θ®–¥ΫαΙΙΦρ ΫΘ©ΘΜ”Ο NaOH±ξΉΦ»ή“ΚΩ…ΒΈΕ®±ΫΝρΖ”»ή“ΚΘ§ΗΟΙΐ≥Χ―Γ”ΟΒΡ÷Η ΨΦΝΈΣ_____ΓΘ
Θ®5Θ©”… DΒΡΫαΙΙΩ…≈–ΕœΘΚD ”Π¥φ‘ΎΝΔΧε“λΙΙΓΘΗΟΝΔΧε“λΙΙΧεΒΡΫαΙΙΦρ ΫΈΣ_____ΓΘ
Θ®6Θ©H «AΒΡΆ§œΒΈοΘ§ΤδœύΕ‘Ζ÷Ή”÷ ΝΩ±»A ¥σ 14ΓΘH ΒΡΆ§Ζ÷“λΙΙΧεΡήΆ§ ±¬ζΉψ»γœ¬ΧθΦΰΒΡΙ≤”–____÷÷Θ®≤ΜΩΦ¬«ΝΔΧε“λΙΙΘ©ΘΚ
ΔΌ±ΫΜΖ…œ”– 3 Ηω»Γ¥ζΜυΘ§«“”ω FeCl3 »ή“Κœ‘…Ϊ
ΔΎΦ»ΡήΖΔ…ζ“χΨΒΖ¥”Π”÷ΡήΖΔ…ζΥ°ΫβΖ¥”Π
–¥≥ωΤδ÷–“Μ÷÷ΚΥ¥≈Ι≤’ώ«βΤΉ”–ΈεΉιΖεΘ§ΖεΟφΜΐ÷°±»ΈΣ 1ΘΚ1ΘΚ1ΘΚ2ΘΚ2 ΒΡΫαΙΙΦρ Ϋ_____ΓΘ
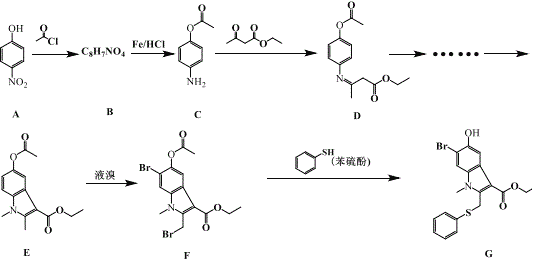
ΓΨ¥πΑΗΓΩΕ‘œθΜυ±ΫΖ”Μρ4-œθΜυ±ΫΖ” ![]() ΜΙ‘≠Ζ¥”Π ±ΘΜΛΖ”τ«Μυ -SH Ζ”ΧΣ
ΜΙ‘≠Ζ¥”Π ±ΘΜΛΖ”τ«Μυ -SH Ζ”ΧΣ 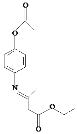 16
16  Μρ
Μρ
ΓΨΫβΈωΓΩ
Θ®1Θ©AΖ÷Ή”“‘±ΫΖ”ΈΣΡΗΧεΘ§Υυ“‘AΒΡΟϊ≥ΤΈΣΕ‘œθΜυ±ΫΖ”Μρ4-œθΜυ±ΫΖ”Θ§ΫαΚœCΒΡΫαΙΙΦρ ΫΘ§Ω…ΆΤ≤βBΒΡΫαΙΙΦρ ΫΈΣΘΚ ΘΜ
ΘΜ
Θ®2Θ©BΒΫCΒΡΖ¥”Π÷–Θ§B÷–ΒΡœθΜυ±ΜΜΙ‘≠ΈΣΑ±ΜυΘΜ
Θ®3Θ©Ζ”τ«ΜυΒΡΜΙ‘≠–‘±»Ϋœ«ΩΘ§Κή»ί“Ή±Μ―θΜ·Θ§Ι ‘ΎΚœ≥…Μ·ΚœΈοGΒΡΝς≥Χ÷–Θ§”…AΒΫBΒΡΡΩΒΡ «±ΘΜΛΖ”τ«ΜυΖά÷Ι±Μ―θΜ·ΘΜ
Θ®4Θ©±ΫΖ”ΒΡΥα–‘±»Ϋœ»θΘ§±ΫΝρΖ”ΒΡ–‘÷ ”κ±ΫΖ”œύΥΤΘ§Ι ±ΫΝρΖ”ΒΡΥα–‘“≤±»Ϋœ»θΘ§ΒΈΕ®‘≠άμ «”Ο«ΩΦνΒΈΕ®»θΥαΘ§―Γ”ΟΖ”ΧΣΉς÷Η ΨΦΝΘΜ
Θ®5Θ©D”Π¥φ‘ΎΝΔΧε“λΙΙΘ§ΡΘΖ¬2-ΕΓœ©ΒΡΥ≥ ΫΓΔΖ¥ Ϋ»Ξ–¥ΘΜ
Θ®6Θ©H «AΒΡΆ§œΒΈοΘ§ΤδœύΕ‘Ζ÷Ή”÷ ΝΩ±»A¥σ14Θ§Ι HΖ÷Ή” Ϋ±»AΒΡΖ÷Ή” ΫΕύ“ΜΗωCH2ΒΡ‘≠Ή”Ά≈Θ§HΒΡΆ§Ζ÷“λΙΙΧεΡήΆ§ ±¬ζΉψ»γœ¬ΧθΦΰΘΚΔΌ±ΫΜΖ…œ”– 3 Ηω»Γ¥ζΜυΘ§«“”ω FeCl3 »ή“Κœ‘…ΪΘ§ΔΎΦ»ΡήΖΔ…ζ“χΨΒΖ¥”Π”÷ΡήΖΔ…ζΥ°ΫβΖ¥”ΠΘ§Ι HΒΡΆ§Ζ÷“λΙΙΧεΒΡΈο÷ 1ΗωΖ÷Ή”÷–Κ§”–1ΗωΖ”τ«ΜυΓΔ-OOCHΓΔ-NH2»ΐΗω»Γ¥ζΜυΘ§Μρ’ΏHΒΡΆ§Ζ÷“λΙΙΧεΒΡΈο÷ 1ΗωΖ÷Ή”÷–Κ§”–2ΗωΖ”τ«ΜυΓΔ1Ηω-NHCHOΓΘ
Θ®1Θ©AΖ÷Ή”“‘±ΫΖ”ΈΣΡΗΧεΘ§Υυ“‘AΒΡΟϊ≥ΤΈΣΕ‘œθΜυ±ΫΖ”Μρ4-œθΜυ±ΫΖ”Θ§ΫαΚœCΒΡΫαΙΙΦρ ΫΘ§Ω…ΆΤ≤βBΒΡΫαΙΙΦρ ΫΈΣΘΚ![]() ΘΜΙ ¥πΑΗΈΣΘΚΕ‘œθΜυ±ΫΖ”Μρ4-œθΜυ±ΫΖ”ΘΜ
ΘΜΙ ¥πΑΗΈΣΘΚΕ‘œθΜυ±ΫΖ”Μρ4-œθΜυ±ΫΖ”ΘΜ![]() ΘΜ
ΘΜ
Θ®2Θ©BΒΫCΒΡΖ¥”Π÷–Θ§B÷–ΒΡœθΜυ±ΜΜΙ‘≠ΈΣΑ±ΜυΘ§Ζ¥”Πάύ–ΆΈΣΜΙ‘≠Ζ¥”ΠΘΜΙ ¥πΑΗΈΣΘΚΜΙ‘≠Ζ¥”ΠΘΜ
Θ®3Θ©‘ΎΚœ≥…Μ·ΚœΈοGΒΡΝς≥Χ÷–Θ§”…”ΎΖ”τ«ΜυΒΡΜΙ‘≠–‘±»Ϋœ«ΩΘ§Ι ”…AΒΫBΒΡΡΩΒΡ «±ΘΜΛΖ”τ«ΜυΘ§Ι ¥πΑΗΈΣΘΚ±ΘΜΛΖ”τ«ΜυΘΜ
Θ®4Θ©±ΫΝρΖ”ΒΡ–‘÷ ”κ±ΫΖ”œύΥΤΘ§±ΫΝρΖ”ΒΡΙΌΡήΆ≈ΈΣ-SHΘ§“ρΈΣ±ΫΖ”ΒΡΥα–‘±»Ϋœ»θΘ§Ι ±ΫΝρΖ”ΒΡΥα–‘“≤±»Ϋœ»θΘ§”Ο NaOH±ξΉΦ»ή“ΚΒΈΕ®±ΫΝρΖ”»ή“ΚΘ§ΒΈΕ®‘≠άμ «”Ο«ΩΦνΒΈΕ®»θΥαΘ§Ω…―Γ”ΟΖ”ΧΣΉς÷Η ΨΦΝΘΜΙ ¥πΑΗΈΣΘΚ-SHΘΜΖ”ΧΣΘΜ
Θ®5Θ©”…DΒΡΫαΙΙΩ…“‘≈–ΕœΘΚD”Π¥φ‘ΎΝΔΧε“λΙΙΘ§ΗΟΝΔΧε“λΙΙΧεΒΡΫαΙΙΦρ ΫΈΣΘΚ ΘΜ
ΘΜ
Θ®6Θ©H «AΒΡΆ§œΒΈοΘ§ΤδœύΕ‘Ζ÷Ή”÷ ΝΩ±»A¥σ14Θ§Ι HΖ÷Ή” Ϋ±»AΒΡΖ÷Ή” ΫΕύ“ΜΗωCH2ΒΡ‘≠Ή”Ά≈Θ§HΒΡΆ§Ζ÷“λΙΙΧεΡήΆ§ ±¬ζΉψ»γœ¬ΧθΦΰΘΚΔΌ±ΫΜΖ…œ”– 3 Ηω»Γ¥ζΜυΘ§«“”ω FeCl3 »ή“Κœ‘…ΪΘ§ΥΒΟςΚ§”–Ζ”τ«ΜυΘΜΔΎΦ»ΡήΖΔ…ζ“χΨΒΖ¥”Π”÷ΡήΖΔ…ζΥ°ΫβΖ¥”ΠΘ§Ι HΒΡΆ§Ζ÷“λΙΙΧεΒΡΈο÷ 1ΗωΖ÷Ή”÷–Κ§”–1ΗωΖ”τ«ΜυΓΔ-OOCHΓΔ-NH2»ΐΗω»Γ¥ζΜυΘ§Μρ’ΏHΒΡΆ§Ζ÷“λΙΙΧεΒΡΈο÷ 1ΗωΖ÷Ή”÷–Κ§”–2ΗωΖ”τ«ΜυΓΔ1Ηω-NHCHOΘΜ
IΘ°Β±HΒΡΆ§Ζ÷“λΙΙΧεΒΡΈο÷ 1ΗωΖ÷Ή”÷–Κ§”–1ΗωΖ”τ«ΜυΓΔ-OOCHΓΔ-NH2»ΐΗω»Γ¥ζΜυ ±ΒΡΆ§Ζ÷“λΙΙΧεΘΚ
iΘ°Β±-OH”κ-OOCH‘Ύ±ΫΜΖ…œ¥Π”ΎΝΎΈΜ ±Θ§-NH2‘Ύ±ΫΜΖ…œ”–4÷÷ΈΜ÷ΟΘΜ
iiΘ°Β±-OH”κ-OOCH‘Ύ±ΫΜΖ…œ¥Π”ΎΦδΈΜ ±Θ§-NH2‘Ύ±ΫΜΖ…œ”–4÷÷ΈΜ÷ΟΘΜ
iiiΘ°Β±-OH”κ-OOCH‘Ύ±ΫΜΖ…œ¥Π”ΎΕ‘ΈΜ ±Θ§-NH2‘Ύ±ΫΜΖ…œ”–2÷÷ΈΜ÷ΟΘΜ
IIΘ°Β±HΒΡΆ§Ζ÷“λΙΙΧεΒΡΈο÷ 1ΗωΖ÷Ή”÷–Κ§”–2ΗωΖ”τ«ΜυΓΔ1Ηω-NHCHO»ΐΗω»Γ¥ζΜυ ±ΒΡΆ§Ζ÷“λΙΙΧεΘΚ
iΘ°Β±ΝΫΗωΖ”τ«Μυ‘Ύ±ΫΜΖ…œ¥Π”ΎΝΎΈΜ ±Θ§-NHCHO‘Ύ±ΫΜΖ…œ”–2÷÷ΈΜ÷ΟΘΜ
iiΘ°Β±ΝΫΗωΖ”τ«Μυ‘Ύ±ΫΜΖ…œ¥Π”ΎΦδΈΜ ±Θ§-NHCHO‘Ύ±ΫΜΖ…œ”–3÷÷ΈΜ÷ΟΘΜ
iiiΘ°Β±ΝΫΗωΖ”τ«Μυ‘Ύ±ΫΜΖ…œ¥Π”ΎΕ‘ΈΜ ±Θ§-NHCHO‘Ύ±ΫΜΖ…œ”–1÷÷ΈΜ÷ΟΘΜ
Ι ¬ζΉψΧθΦΰΒΡHΒΡΆ§Ζ÷“λΙΙΧεΙ≤”–16÷÷ΘΜΤδ÷–“Μ÷÷ΚΥ¥≈Ι≤’ώ«βΤΉ”–ΈεΉιΖεΘ§ΖεΟφΜΐ÷°±»ΈΣ 1ΘΚ1ΘΚ1ΘΚ2ΘΚ2ΒΡΫαΙΙΦρ ΫΈΣΘΚ Μρ
Μρ ΘΜΙ ¥πΑΗΈΣΘΚ16ΘΜ
ΘΜΙ ¥πΑΗΈΣΘΚ16ΘΜ Μρ
Μρ ΓΘ
ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΔώΓΔ‘ΎΫπΗ’ ·ΓΔCS2ΓΔN2ΓΔC2H4ΓΔH2O2ΓΔΫπ τFe Β»Νυ÷÷ΨßΧε÷–ΘΚ
Θ®1Θ©“‘Ζ«ΦΪ–‘ΦϋΫαΚœΒΡΖ«ΦΪ–‘Ζ÷Ή” «______________ΘΜ
Θ®2Θ©Ά®ΙΐΖ«ΦΪ–‘Φϋ–Έ≥…ΒΡ‘≠Ή”ΨßΧε «______________ΘΜ
Θ®3Θ©Κ§”–ΦΪ–‘Ι≤ΦέΦϋΚΆΖ«ΦΪ–‘Ι≤ΦέΦϋΒΡΖ«ΦΪ–‘Ζ÷Ή” «______________ΘΜ
Θ®4Θ©ΙΧΧ§ΚΆ»έ»ΎΉ¥Χ§œ¬ΕΦΡήΒΦΒγΒΡΨßΧε «______________ΘΜ
ΔρΓΔCΚΆSi‘ΣΥΊ‘ΎΜ·―ß÷–’Φ”–ΦΪΤδ÷Ί“ΣΒΡΒΊΈΜΘ°
Θ®1Θ©CO2 τ”Ύ______________ΨßΧεΘ§»έΜ· ±ΩΥΖΰΒΡΈΔΝΘΦδΉς”ΟΝΠ «______________ΘΜSiO2 τ”Ύ______________ΨßΧεΘ§»έΜ· ±ΩΥΖΰΒΡΈΔΝΘΦδΉς”ΟΝΠ «______________ΘΜΥυ“‘»έΒψCO2 ______________SiO2(ΧνΓΑΘΦΓ±ΓΔΓΑ=Γ±ΜρΓΑΘΨΓ±Θ©Θ°
Θ®2Θ©SiO2ΨßΧε÷–ΟΩΗωΙη”κ______________ΗωOœύΝ§Θ§ΟΩΗω―θ”κ______________SiœύΝ§Θ°
Θ®3Θ© ·ΡΪΨßΧε÷–Θ§≤ψΡΎ–Έ≥…’ΐΝυ±Ώ–ΈΒΡΤΫΟφΆχΉ¥ΫαΙΙΘ§ ‘Ζ÷Έω≤ψΡΎΟΩΗω’ΐΝυ±Ώ–Έ’Φ”–ΒΡΧΦ‘≠Ή” ΐΈΣ___________ΗωΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
ΔΌ÷ Ή” ΐœύΆ§ΒΡΈΔΝΘ“ΜΕ® τ”ΎΆ§“Μ÷÷‘ΣΥΊ
ΔΎΆ§“Μ‘ΣΥΊΒΡΚΥΥΊ÷÷ ΐ”…÷–Ή” ΐΨωΕ®
ΔέCl2÷–35Cl”κ37ClΝΫ÷÷ΚΥΥΊΒΡΗω ΐ÷°±»”κHCl÷–35Cl”κ37ClΒΡΗω ΐ÷°±»œύΒ»
Δή18 g H2O÷–Κ§”–ΒΡ÷–Ή” ΐΈΣ10 NA
ΔίάκΉ”Μ·ΚœΈο÷–“ΜΕ®Κ§”–Ϋπ τ‘ΣΥΊ
Δό÷Μ”–ΜνΤΟΫπ τ‘ΣΥΊ”κΜνΤΟΖ«Ϋπ τ‘ΣΥΊ÷°Φδ≤≈Ρή–Έ≥…άκΉ”Φϋ
ΔΏάκΉ”Μ·ΚœΈο÷–“ΜΕ®Κ§”–“θάκΉ”ΚΆ―τάκΉ”
ΔύΆ®ΙΐΜ·―ß±δΜ·Ω…“‘ Βœ÷16O”κ18OΦδΒΡœύΜΞΉΣΜ·
A.2ΗωB.3ΗωC.4ΗωD.5Ηω
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩY «“Μ÷÷Χλ»Μ≥ΐ≤ίΦΝΘ§ΤδΫαΙΙ»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
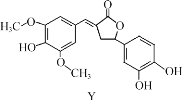
A.Y Ω…“‘ΚΆNaHCO3 »ή“ΚΖΔ…ζΖ¥”Π
B.Y Ζ÷Ή”÷–Υυ”–ΧΦ‘≠Ή”“ΜΕ®‘ΎΆ§“ΜΤΫΟφΡΎ
C.1 mol Y ΉνΕύΡή”κ 6 mol NaOH Ζ¥”Π
D.Y ”κΉψΝΩΒΡH2Φ”≥…Ζ¥”ΠΒΡ≤ζΈοΚ§ 7 Ηω ÷–‘ΧΦ‘≠Ή”
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩXΓΔYΓΔZΓΔQΓΔR «‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΒΡΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊΓΘ“―÷ΣΘΚΤχΧεYX3Ρή Ι»σ ΣΒΡΉœ…Ϊ ·»ο ‘÷Ϋ±δάΕΘ§ZΚΆX‘ΎΆ§“Μ÷ςΉεΘ§Q‘≠Ή”ΒΡΉνΆβ≤ψΒγΉ” ΐ «Τδ÷ήΤΎ–ρ ΐΒΡ2±ΕΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©![]() ‘≠Ή”ΒΡΫαΙΙ Ψ“βΆΦΈΣ _____Θ§YX3ΒΡΜ·―ß ΫΈΣ _____ΓΘ
‘≠Ή”ΒΡΫαΙΙ Ψ“βΆΦΈΣ _____Θ§YX3ΒΡΜ·―ß ΫΈΣ _____ΓΘ
Θ®2Θ©![]() ΓΔQΓΔR‘≠Ή”ΒΡΑκΨΕ¥”¥σΒΫ–ΓΒΡΥ≥–ρ « ___________ΓΘ
ΓΔQΓΔR‘≠Ή”ΒΡΑκΨΕ¥”¥σΒΫ–ΓΒΡΥ≥–ρ « ___________ΓΘ![]() ”Ο‘≠Ή”ΖϊΚ≈±μ Ψ
”Ο‘≠Ή”ΖϊΚ≈±μ Ψ![]() ΓΘ
ΓΘ
Θ®3Θ©![]() Ζ÷±π”κXΓΔZ–Έ≥…ΒΡΜ·ΚœΈοΖ÷±π «__________Θ®ΧνΜ·―ß ΫΘ©Θ§___________Θ®ΧνΒγΉ” ΫΘ©ΓΘQ”κZ–Έ≥…ΒΡΜ·ΚœΈοάύ–Ά «_________Θ®ΧνάκΉ”Μ·ΚœΈοΜρΙ≤ΦέΜ·ΚœΈοΘ©ΓΘ
Ζ÷±π”κXΓΔZ–Έ≥…ΒΡΜ·ΚœΈοΖ÷±π «__________Θ®ΧνΜ·―ß ΫΘ©Θ§___________Θ®ΧνΒγΉ” ΫΘ©ΓΘQ”κZ–Έ≥…ΒΡΜ·ΚœΈοάύ–Ά «_________Θ®ΧνάκΉ”Μ·ΚœΈοΜρΙ≤ΦέΜ·ΚœΈοΘ©ΓΘ
Θ®4Θ©Ρή÷ΛΟςRΒΡΖ«Ϋπ τ–‘±»Q«ΩΒΡ Β―ι ¬ Β «______![]() ΧνΉ÷ΡΗ–ρΚ≈
ΧνΉ÷ΡΗ–ρΚ≈![]() ΓΘ
ΓΘ
A HRΒΡΥ°»ή“ΚΥα–‘±»H2QΒΡΥ°»ή“ΚΥα–‘«Ω B R2”κH2Μ·Κœ±»Q”κH2Μ·Κœ»ί“ΉΓΘ
C RΒΡΉνΗΏΦέ―θΜ·ΈοΒΡΥ°Μ·ΈοΒΡΥα–‘±»QΒΡ«Ω D HRΒΡΈ»Ε®–‘±»H2Q«Ω
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦΥυ ΨΒΡΥΪ“Κ‘≠Βγ≥ΊΘ§œ¬Ν––π ω’ΐ»ΖΒΡ «Θ® Θ©
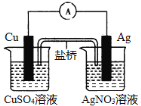
A.CuΈΣΒγ≥ΊΗΚΦΪ
B.AgΒγΦΪ…œΖΔ…ζ―θΜ·Ζ¥”Π
C.―Έ«≈÷–ΒΡ―τάκΉ”œρΉσ≥Ί“ΤΕ·
D.ΆβΒγ¬Ζ÷–Θ§ΒγΝς¥”CuΒγΦΪΝςœρAgΒγΦΪ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩNA¥ζ±μΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΓΘœ¬Ν––π ω’ΐ»ΖΒΡ «Θ® Θ©
A.1molΧΦ’ΐάκΉ”Θ®CH3ΘΪΘ©ΥυΚ§ΒΡΒγΉ”Ήή ΐΈΣ9NA
B.25ΓφΘ§pHΘΫ13ΒΡBa(OH)2 »ή“Κ÷–Κ§”–OHΘ≠ΒΡ ΐΡΩΈΣ0.1NA
C.≥ΘΈ¬≥Θ―Ιœ¬Θ§Ιΐ―θΜ·ΡΤ”κΥ°Ζ¥”Π ±Θ§…ζ≥…8g―θΤχΉΣ“ΤΒΡΒγΉ” ΐΈΣ0.5NA
D.1mol–έΜΤ(As4S4)Θ§ΫαΙΙ»γΆΦΘΚ![]() Θ§Κ§”–2NAΗωSΘ≠SΦϋ
Θ§Κ§”–2NAΗωSΘ≠SΦϋ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩτ ΜυΝρ(COS)Ω…ΉςΈΣ“Μ÷÷ΝΗ ≥―§’τΦΝΘ§ΡήΖά÷ΙΡ≥–©άΞ≥φΓΔœΏ≥φΚΆ’φΨζΒΡΈΘΚΠΓΘ‘ΎΚψ»ίΟή±’»ίΤς÷–Θ§ΫΪCOΚΆH2SΜλΚœΦ”»»≤Δ¥οΒΫœ¬Ν–ΤΫΚβΘΚCO(g)+H2S(g)COS(g)+H2(g) K=0.1Θ§Ζ¥”Π«ΑCOΈο÷ ΒΡΝΩΈΣ10molΘ§ΤΫΚβΚσCOΈο÷ ΒΡΝΩΈΣ8molΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «
A.…ΐΗΏΈ¬Ε»Θ§H2S≈®Ε»‘ωΦ”Θ§±μΟςΗΟΖ¥”Π «Ζ≈»»Ζ¥”Π
B.COΒΡΤΫΚβΉΣΜ·¬ ΈΣ20%
C.Ζ¥”Π«ΑH2SΒΡΈο÷ ΒΡΝΩΈΣ7mol
D.Ά®»κCOΚσΘ§’ΐΖ¥”ΠΥΌ¬ ÷πΫΞ‘ω¥σ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒΣΦΑΤδΜ·ΚœΈο‘ΎΙΛ“Β…ζ≤ζΒ»ΖΫΟφ”–÷Ί“ΣΒΡ”Π”ΟΓΘΙΛ“ΒΚœ≥…Α± «ΟΚΜ·ΙΛ≤ζ“ΒΝ¥÷–Ζ«≥Θ÷Ί“ΣΒΡ“Μ≤ΩΖ÷Θ§ΖΔ…δΈά–« ±Ω…”Οκ¬(N2H4)Ής»ΦΝœΓΘ
(1)“―÷ΣΘΚ17g NH3(g)‘Ύ“ΜΕ®ΧθΦΰœ¬Ζ÷Ϋβ…ζ≥…N2(g)ΚΆH2(g)Θ§Έϋ ’46.1kJΒΡ»»ΝΩΓΘ‘ρΖ¥”ΠN2(g)+3H2(g)=2NH3(g) ΓςH=_______________kJΓΛmol-1
(2)‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§œρ»ίΜΐΈΣ5LΒΡΚψ»ίΟή±’»ίΤς÷–≥δ»κ1mol N2ΓΔ3molH2Θ§10minΚσΘ§≤βΒΟ»ίΤςΡΎNH3ΈΣ1molΘ§‘ρ”ΟN2±μ ΨΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ______________________ΓΘ
(3)“―÷Σ‘Ύ298K ±1gκ¬ΤχΧε»Φ…’…ζ≥…N2ΚΆΥ°’τΤχΘ§Ζ≈≥ω16.7kJΒΡ»»ΝΩΓΘœ¬Ν–»»Μ·―ßΖΫ≥Χ Ϋ ι–¥’ΐ»ΖΒΡ «__________(ΧνΉ÷ΡΗ–ρΚ≈)
A.N2H4+O2=N2+2H2O ΓςH=Θ≠534.4kJΓΛmolΓΣ1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΓςH=Θ≠534.4kJΓΛmolΓΣ1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΓςH=Θ≠534.4kJΓΛmolΓΣ1
D.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΓςH=Θ≠16.7kJΓΛmolΓΣ1
(4)N2H4ΓΔO2ΚΆKOH»ή“ΚΉι≥…ΒΡ»ΦΝœΒγ≥Ί…ζ≥…Υ°ΚΆΒΣΤχΓΘ
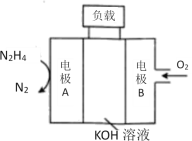
ΔΌΗΚΦΪΖ¥”Π ΫΈΣ_____________ΓΘ
ΔΎΖ≈Βγ ±Θ§»ή“Κ÷–ΒΡ“θάκΉ”œρ_______ΦΪ“ΤΕ·(ΧνΓΑ’ΐΓ±ΜρΓΑΗΚΓ±)ΓΘ
ΔέΖ≈Βγ ±Θ§’ΐΦΪ«χ»ή“ΚΒΡΦν–‘___________(ΧνΓΑ‘ω«ΩΓ±ΓΔΓΑΦθ»θΓ±ΜρΓΑ≤Μ±δΓ±)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com