
����Ŀ�������仯�����ڹ�ҵ�����ȷ�������Ҫ��Ӧ�á���ҵ�ϳɰ���ú������ҵ���зdz���Ҫ��һ���֣���������ʱ������(N2H4)��ȼ�ϡ�
(1)��֪��17g NH3(g)��һ�������·ֽ�����N2(g)��H2(g)������46.1kJ����������ӦN2(g)+3H2(g)=2NH3(g) ��H=_______________kJ��mol-1
(2)��һ�������£����ݻ�Ϊ5L�ĺ����ܱ������г���1mol N2��3molH2��10min���������NH3Ϊ1mol������N2��ʾ��ƽ����Ӧ����Ϊ______________________��
(3)��֪��298Kʱ1g������ȼ������N2��ˮ�������ų�16.7kJ�������������Ȼ�ѧ����ʽ��д��ȷ����__________(����ĸ���)
A.N2H4+O2=N2+2H2O ��H=��534.4kJ��mol��1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) ��H=��534.4kJ��mol��1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H=��534.4kJ��mol��1
D.N2H4(g)+O2(g)= N2(g)+2H2O(g) ��H=��16.7kJ��mol��1
(4)N2H4��O2��KOH��Һ��ɵ�ȼ�ϵ������ˮ�͵�����
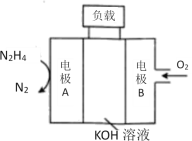
�ٸ�����ӦʽΪ_____________��
�ڷŵ�ʱ����Һ�е���������_______���ƶ�(����������������)��
�۷ŵ�ʱ����������Һ�ļ���___________(������ǿ����������������������)��
���𰸡�-92.2 0.01 mol��L-1��min-1 C N2H4��4e����4OH��= N2����4H2O �� ��ǿ
��������
(1)����17g NH3(g)��һ�������·ֽ�����N2(g)��H2(g)������46.1kJ����������1molNH3(g)��һ�������·ֽ����յ��������ϳɰ����Ƿֽⰱ������������պͷų���������ֵ��ȣ��ݴ˼�����д��
(2)���������NH3��Ӧ���ʣ����÷�Ӧ����֮�ȵ��ڷ�Ӧ����ϵ��֮�ȣ�����N2��ƽ����Ӧ���ʣ�
(3)1g��̬����������ȼ�����ɵ�����Һ̬ˮʱ���ɷų�17kJ��������32gN2H4ȼ������CO2��Һ̬ˮʱ����17kJ��32=544kJ��1molN2H4����Ϊ32�ˣ�������ȫȼ��1molN2H4���ɵ�����Һ̬ˮ����544kJ��������д�Ȼ�ѧ����ʽע��㣬����ע������Ӧ��������״̬��s��l��g��aq�������������������������ţ���Hֻ��д�ڱ��з�Ӧ���������״̬�Ļ�ѧ����ʽ���ұߣ���Ϊ���ȷ�Ӧ����HΪ��+������Ϊ���ȷ�Ӧ����HΪ��-������H�ĵ�λһ��ΪkJ/mol��д�Ȼ�ѧ����ʽ���ݴ˼��ɽ��
(4) �¡��������������ع���ȼ�ϵ�أ�ͨ��ȼ�ϵ�һ��Ϊ������ͨ��������һ��Ϊ��������AΪ������BΪ��������������ʧ���Ӻ����������ӷ�Ӧ���ɵ�����ˮ���缫��ӦʽΪN2H4+4OH--4e-=4H2O+N2���������������õ��Ӻ�ˮ��Ӧ�������������ӣ�������ӦΪ��O2+2H2O+4e-=4OH-������ܷ�ӦΪ��N2H4+O2=N2+2H2O���ŵ�ʱԭ��������������ƶ������ݵ������Һ�ı仯��������ҺpH�ı仯��
(1)��֪��17g NH3(g)��Ϊ1mol����һ�������·ֽ�����N2(g)��H2(g)������46.1kJ����������2mol NH3(g) ��һ�������·ֽ�����N2(g)��H2(g)������46.1kJ��2mol=92.2kJ���������ϳɰ����Ƿֽⰱ��������̣����պͷų���������ֵ��ȣ��ϳɰ����Ƿ��ȷ�Ӧ����ӦN2(g)+3H2(g)2NH3(g) ��H=-92.2kJ��mol-1��
(2)��һ�������£����ݻ�Ϊ5L�ĺ����ܱ������г���1mol N2��3molH2��10min���������NH3Ϊ1mol����NH3��Ũ�ȱ仯��=![]() =0.2mol/L��10min��NH3��ƽ����Ӧ����=
=0.2mol/L��10min��NH3��ƽ����Ӧ����=![]() =0.02mol��L-1��min-1�����ݷ�ӦN2(g)+3H2(g)2NH3(g) ����Ӧ����֮�ȵ��ڷ�Ӧ����ϵ��֮�ȣ�v(N2)=
=0.02mol��L-1��min-1�����ݷ�ӦN2(g)+3H2(g)2NH3(g) ����Ӧ����֮�ȵ��ڷ�Ӧ����ϵ��֮�ȣ�v(N2)=![]() v(NH3)=
v(NH3)=![]() ��0.02mol��L-1��min-1=0.01mol��L-1��min-1��
��0.02mol��L-1��min-1=0.01mol��L-1��min-1��
(3) 1molN2H4����Ϊ32�ˣ�1g��̬����������ȼ�����ɵ�����Һ̬ˮʱ���ɷų�16.7kJ��������1molN2H4����Ϊ32�ˣ���32gN2H4ȼ�����ɵ�����Һ̬ˮʱ����16.7kJ��32=534.4kJ��������д�Ȼ�ѧ����ʽע�����ȷ�Ӧ����HΪ���������ԣ���H=534.4kJmol1��N2H4��O2��N2��H2O��Ϊ��̬�����Է�Ӧ���Ȼ�ѧ����ʽΪ��N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H=��534.4kJ��mol��1����ѡC��
(4)�ٸ��ݷ�����������ӦʽΪN2H4+4OH--4e-=4H2O+N2����
�ڷŵ�ʱΪԭ��أ�ԭ����е����������ƶ�������Һ�е����������ƶ���
�۸��ݷ����ŵ�ʱ��������ӦΪ��O2+2H2O+4e-=4OH-���������������������ӣ���Һ�ļ�����ǿ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȶ������Ч��������״������������ G �Ǻϳɰ��ȶ�����м��壬��ϳ�·�����£�
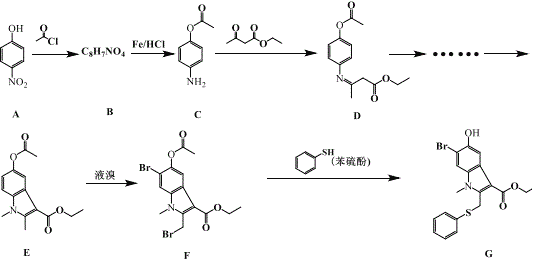
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_____��B �Ľṹ��ʽΪ_____��
��2���� B ��C �ķ�Ӧ���ͷֱ�Ϊ________________��
��3���ںϳɻ�����G�������У���A��B��Ŀ����________________________��
��4������ӵ������뱽�����ƣ�����ӵĹ�����Ϊ_____��д�ṹ��ʽ������ NaOH����Һ�ɵζ��������Һ���ù���ѡ�õ�ָʾ��Ϊ_____��
��5���� D�Ľṹ���жϣ�D Ӧ���������칹���������칹��Ľṹ��ʽΪ_____��
��6��H ��A��ͬϵ�����Է���������A �� 14��H ��ͬ���칹����ͬʱ�������������Ĺ���____�֣������������칹����
�ٱ������� 3 ��ȡ���������� FeCl3 ��Һ��ɫ
�ڼ��ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
д������һ�ֺ˴Ź�������������壬�����֮��Ϊ 1��1��1��2��2 �Ľṹ��ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���Ӧ����һ���ܴ���������ǣ� ��
A.������Һ�У�Mg2+��Fe3+��CO32-��SO42-
B.ʹ���ȱ�����Һ�У�NH4+��Al3+��Cl-��Mg2+
C.25��ʱ��ˮ�������c(H+)=1��10-13mol��L-1��K+��Ba2+��NO3-��S2-
D.![]() =1��1012����Һ�У�Fe2+��NO3-��HCO3-��Na+
=1��1012����Һ�У�Fe2+��NO3-��HCO3-��Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ��۲���ȷ����
A.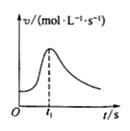 þ�������ᷴӦ�Ļ�ѧ��Ӧ������ʱ��仯�����ߣ�˵��t1ʱ����Һ���¶����
þ�������ᷴӦ�Ļ�ѧ��Ӧ������ʱ��仯�����ߣ�˵��t1ʱ����Һ���¶����
B.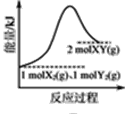 ��1mol X2(g)��1mol Y2(g)��Ӧ����2mol XY(g)�������仯���ߣ�˵����Ӧ��������ѧ���ļ����ܺ�С��������������ѧ���ļ����ܺ�
��1mol X2(g)��1mol Y2(g)��Ӧ����2mol XY(g)�������仯���ߣ�˵����Ӧ��������ѧ���ļ����ܺ�С��������������ѧ���ļ����ܺ�
C. �Ǻ����ܱ������з���CaCO3(s)CaO(s)��CO2(g)��Ӧʱc(CO2)�淴Ӧʱ��仯�����ߣ�˵��t1ʱ�̸ı��������������С���������
�Ǻ����ܱ������з���CaCO3(s)CaO(s)��CO2(g)��Ӧʱc(CO2)�淴Ӧʱ��仯�����ߣ�˵��t1ʱ�̸ı��������������С���������
D. �������£�I2+I��I3����ƽ��Ũ�����¶ȱ仯�����ߣ�˵��ƽ�ⳣ��K(T1)��K(T2)
�������£�I2+I��I3����ƽ��Ũ�����¶ȱ仯�����ߣ�˵��ƽ�ⳣ��K(T1)��K(T2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п����صĸ���Ϊп������Ϊ���������������KOH����ط�ӦΪZn��Ag2O��H2O=Zn(OH)2��2Ag����п�����Ϊ��Դ�������������Һұ��������װ����ͼ��ʾ������˵����ȷ���ǣ� ��
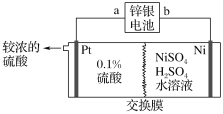
A.װ����ʹ�������ӽ���Ĥ
B.п�����a����ӦʽΪAg2O��H2O��2e��=2Ag��2OH��
C.���������ϡ���ᣬ����õ��Ƚ�Ũ������
D.��п������ܽ�13 gп�������������������Ϊ5.9 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦH2(g)+O2(g)=H2O(g)�������仯��ͼ��ʾ��a��b��c��ʾ�����仯��Ϊ��ֵ����λΪkJ������˵����ȷ����
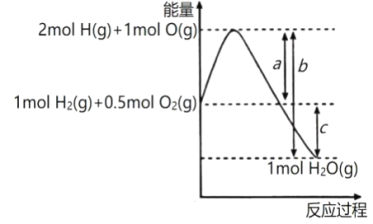
A. �γ�1 mol H2O(g)�еĻ�ѧ����Ҫ����bkJ������
B. 2H2O(g)==2H2(g)+O2(g) ��H=-2(a-b) kJmol-1
C. H2O(l)==H2(g)��O2(g) ��H��ckJ��mol��1
D. 2molH2(g)��1molO2(g)��ȫ��Ӧ����2molH2O(l)�ų�������С��2(b-a) kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2H2S��g��+SO2��g���T3S��s��+2H2O��l����H1����154 kJmol��1
��S��s��+O2��g���TSO2��g����H2����297 kJmol��1
��2H2S��g��+O2��g���T2S��s��+2H2O��l����H3
��2H2S��g��+3O2��g���T2SO2��g��+2H2O��l����H4
����˵����ȷ����
A.��H3����H4B.��H3��+143 kJmol��1
C.��������H4��ֵD.H2S ȼ����Ϊ 1045 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10 L���ܱ������У�1 mol A��1 mol B���з�Ӧ��2A(g)��B(g)![]() 2C(g)����60 s�ﵽƽ�⣬����0.6 mol C������˵����ȷ����
2C(g)����60 s�ﵽƽ�⣬����0.6 mol C������˵����ȷ����
A. ��AŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.001 mol��L��1��s��1
B. �����������䣬�����������Ϊ5 L��C��ƽ��Ũ�ȱ�Ϊԭ����2��
C. �����������䣬������ѹǿ��������A��ת���ʼ�С
D. �ﵽƽ��ʱ��C������ٷֺ���Ϊ0.353
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ȥ��������Ĥ��Al��CuƬ����ŨHNO3�����ԭ��أ�ͼ1),���ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ2��ʾ,����˵����ȷ����

A. 0-t1ʱ��ԭ��صĸ�����ͭƬ
B. 0-t1ʱ�������ĵ缫��Ӧʽ��2H++2e-=H2��
C. t1ʱ�̣������������仯��ԭ����Al ��Ũ�����з����ۻ�������Ĥ��ֹ��Al��һ����Ӧ
D. tlʱ�̺��Ӵ���������������ͭ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com