
【题目】已知:①2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H1=﹣154 kJmol﹣1
②S(s)+O2(g)═SO2(g)△H2=﹣297 kJmol﹣1
③2H2S(g)+O2(g)═2S(s)+2H2O(l)△H3
④2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H4
下列说法正确的是
A.△H3>△H4B.△H3=+143 kJmol﹣1
C.无法计算△H4的值D.H2S 燃烧热为 1045 kJmol﹣1
【答案】A
【解析】
根据盖斯定律:
①+②得到③2H2S(g)+O2(g)═2S(s)+2H2O(l)△H3=(-154 kJ·mol-1)+(-297kJ·mol-1)=-451 kJ·mol-1,
①+3×②得到④2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H4=(-154 kJ·mol-1)+3×(-297kJ·mol-1)=-1045 kJ·mol-1,即H2S(g)+![]() O2(g)=SO2(g)+H2O(l)△H=(-1045 kJ·mol-1)×
O2(g)=SO2(g)+H2O(l)△H=(-1045 kJ·mol-1)×![]() =-522.5 kJ·mol-1,
=-522.5 kJ·mol-1,
A、△H3=-451 kJ·mol-1,△H4=-1045 kJ·mol-1,所以△H3>△H4,故A正确;
B、△H3=-451 kJ·mol-1,故B错误;
C、①+3×②得到△H4=-1045 kJ·mol-1,故C错误;
D、H2S 燃烧热的热化学方程式为H2S(g)+![]() O2(g)=SO2(g)+H2O(l)△H=-522.5 kJ·mol-1,所以H2S 燃烧热为522.5kJ·mol-1,故D错误;
O2(g)=SO2(g)+H2O(l)△H=-522.5 kJ·mol-1,所以H2S 燃烧热为522.5kJ·mol-1,故D错误;
故选:A。


科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol碳正离子(CH3+)所含的电子总数为9NA
B.25℃,pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA
C.常温常压下,过氧化钠与水反应时,生成8g氧气转移的电子数为0.5NA
D.1mol雄黄(As4S4),结构如图:![]() ,含有2NA个S-S键
,含有2NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝合金与硝酸恰好完全反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下3.36 L O2混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2 mol/L NaOH溶液至沉淀最多时停止加入,将沉淀滤出,向滤液中加水稀释至500 mL,此时所得溶液的物质的量浓度为( )
A. 0.5 mol/LB. 1 mol/L
C. 1.2 mol/LD. 2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产等方面有重要的应用。工业合成氨是煤化工产业链中非常重要的一部分,发射卫星时可用肼(N2H4)作燃料。
(1)已知:17g NH3(g)在一定条件下分解生成N2(g)和H2(g),吸收46.1kJ的热量。则反应N2(g)+3H2(g)=2NH3(g) △H=_______________kJ·mol-1
(2)在一定条件下,向容积为5L的恒容密闭容器中充入1mol N2、3molH2,10min后,测得容器内NH3为1mol,则用N2表示的平均反应速率为______________________。
(3)已知在298K时1g肼气体燃烧生成N2和水蒸气,放出16.7kJ的热量。下列热化学方程式书写正确的是__________(填字母序号)
A.N2H4+O2=N2+2H2O △H=-534.4kJ·mol—1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534.4kJ·mol—1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.4kJ·mol—1
D.N2H4(g)+O2(g)= N2(g)+2H2O(g) △H=-16.7kJ·mol—1
(4)N2H4、O2和KOH溶液组成的燃料电池生成水和氮气。
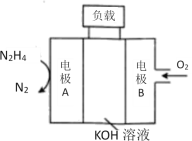
①负极反应式为_____________。
②放电时,溶液中的阴离子向_______极移动(填“正”或“负”)。
③放电时,正极区溶液的碱性___________(填“增强”、“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应H2(g)+ I2(g) 2HI(g) △H<0在一密闭体系中达到化学平衡。在448℃时,该反应的化学平衡常数为49。
(1)请写出该反应的平衡常数的表达式__________。
(2)下列说法中能说明该反应已达平衡状态的是______________(用字母序号填空)
A.压强不再改变
B.速率之比 v(H2):v(I2):v(HI)=1:1:2
C.混合气体的颜色不再改变
D.混合气体的密度不再改变
(3)只改变下列条件,该化学平衡如何移动?①向正反应方向移动;②向逆反应方向移动;③不移动。升高温度__________;(用数字序号填空,下同)缩小容器的体积___________;保持体积不变,通入氢气___________;保持压强不变,通入氩气____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沐舒坦(结构简式为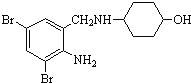 ,不考虑立体异构)在临床上使用广泛。如图所示是其多条合成路线中的一条(反应试剂和反应条件均未标出)。
,不考虑立体异构)在临床上使用广泛。如图所示是其多条合成路线中的一条(反应试剂和反应条件均未标出)。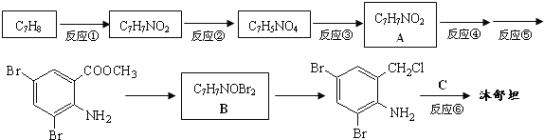
已知:![]() ,完成下列填空:
,完成下列填空:
(1)⑤的反应试剂和反应条件是___________;③的反应类型是___________。
(2)已知反应④所需的试剂是甲醇,则该反应的化学方程式是______________________________________。
(3)写出结构简式:A________________;B________________。
(4)反应⑥中除加入反应试剂C外,还需要加入K2CO3,其目的是为了中和____________;防止___________________________________。
(5)写出两种C的能发生水解反应,且只含3种不同化学环境氢原子的同分异构体的结构简式:_____________________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。化合物AC2为一种常见的温室气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态E原子的核外电子排布式是________,在第四周期中,与基态E原子最外层电子数相同还有_______(填元素符号)。
(2)A、B、C的第一电离能由小到大的顺序为____________。
(3)写出化合物AC2的电子式_____________。
(4)D的单质在AC2中点燃可生成A的单质与一种熔点较高的固体产物,写出其化学反应方程式:__________。
(5)1919年,Langmuir提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。此后,等电子原理又有发展,例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。一种由B、C组成的化合物与AC2互为等电子体,其化学式为_____。
(6)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(H+) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃0.5mol能与0.5molCl2完全加成,加成产物又可被3molCl2完全取代,则此气态烃可能是
A.CH2=CH2B.CH3-CH=CH2
C.CH2=CHCH2CH3D.CH2=CH-CH=CH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com