
����Ŀ��ij��ɫ��Һ�п��ܺ���Na+��NH4+��Fe2+��Fe3+��Cl����SO42����CO32��������(������ˮ�ĵ�������ӵ�ˮ��)��ijͬѧΪ��ȷ������֣���Ʋ����������ʵ�飺
����˵����ȷ����( )
A.c(Fe3+)һ��Ϊ0.2molL��1
B.Cl��һ������
C.Na+��SO42��һ�����ڣ�NH4+һ��������
D.Na+��Fe2+���ܴ��ڣ�CO32��һ��������
���𰸡�BD
��������
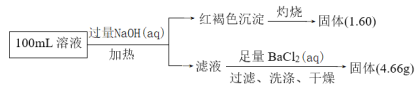
ij��ɫ��Һ�п��ܺ���Na����NH4����Fe2����Fe3����Cl����SO42����CO32�������ӣ���Ϊ�Ի�ɫ������Һһ����Fe3�����������NaOH��Һ�����ȣ������ĺ��ɫ����Ϊ�������������յõ�1.6g����ΪFe2O3�������ʵ���![]() ����ԭ��Һ�к���0.02mol���������ӣ�һ����Fe3�������ܺ���Fe2��������CO32����Fe3������ٽ�ˮ�⣬�����ܴ������棬��ԭ��Һ��һ��û��CO32������֪4.66g����ΪBaSO4�������ʵ���
����ԭ��Һ�к���0.02mol���������ӣ�һ����Fe3�������ܺ���Fe2��������CO32����Fe3������ٽ�ˮ�⣬�����ܴ������棬��ԭ��Һ��һ��û��CO32������֪4.66g����ΪBaSO4�������ʵ���![]() ����ԭ��Һ�к���0.02molSO42�������ڼ����˹�����NaOH�����ж�ԭ��Һ���Ƿ���Na�����ɵ���غ㣬������������ȫ��ΪFe3����������ɵ����ʵ���=3n(Fe3��)=0.06mol������ɵ����ʵ���=2n(SO42��)=0.04mol��ԭ��Һ��һ����Cl�������ʵ���ӦΪ 0.02mol��3-0.02mol��2=0.02mol����������������Fe2��ʱ����Cl�����ʵ���С��0.02mol��
����ԭ��Һ�к���0.02molSO42�������ڼ����˹�����NaOH�����ж�ԭ��Һ���Ƿ���Na�����ɵ���غ㣬������������ȫ��ΪFe3����������ɵ����ʵ���=3n(Fe3��)=0.06mol������ɵ����ʵ���=2n(SO42��)=0.04mol��ԭ��Һ��һ����Cl�������ʵ���ӦΪ 0.02mol��3-0.02mol��2=0.02mol����������������Fe2��ʱ����Cl�����ʵ���С��0.02mol��
A����Һ�к������ӵ����ʵ���Ϊ0.02mol����Һ��Fe2������NaOH������Fe(OH)2�����ձ�������Fe(OH)3��Ҳ��ת��ΪFe2O3����ԭ��Һ��c(Fe3��) ��![]() ��A����
��A����
B���������Ϸ�����ԭ��Һ��һ����Cl����B��ȷ��
C�����ڼ���������������Һ�����ж�ԭ��Һ���Ƿ��������ӣ�C����
D���������Ϸ�����Na����Fe2�����ܴ��ڣ�CO32��һ�������ڣ�D��ȷ��
��ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊm g��ͭ˿���ձ�ڣ������������������У�ʹͭ˿��죬����������Ϊm����
A.H2SO4B.C2H5OHC.ϡHNO3D.NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��WΪԭ��������������Ķ�����Ԫ�أ�Y��WΪͬһ����Ԫ����Wԭ�ӵ���������������Yԭ�ӵĺ���������������γɵ�һ�ֻ�����ṹ��ͼ��ʾ������������ȷ����
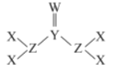
A.ԭ�Ӱ뾶:W>Z>Y>X
B.�û������и�Ԫ�ص�ԭ������������8���ӽṹ
C.X��Y�γɵĶ�Ԫ�����ﳣ����һ��Ϊ��̬
D.X��Y��Z��W���γ�ԭ�Ӹ�����8��1��2��3�Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�п��Է��������������ЧӦ�Ļ�ѧ���������������ᣬ��������Ľṹ��ʽ��ͼ��ʾ�������й�˵����ȷ����
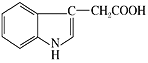
A.�����к���2�ֹ�����
B.�������ᱽ���ϵĶ��ȴ��ﹲ������
C.1 mol������������������������Ӧ���������5 mol H2
D.�����в�������̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(M)���������(��ͼ)����ԭ���á������ܶȸߵ��ŵ㣬������Ϊ����Դ�������ƶ��豸�ĵ�Դ�������طŵ���ܷ�ӦΪ��4M + nO2 + 2nH2O = 4M(OH)n����֪����ص������۱�������ָ��λ�����ĵ缫�������������ͷų��������ܡ�����˵������ȷ����
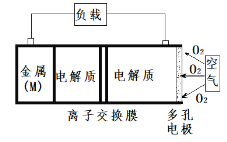
A.��缫������������ɢ���缫���棬����߷�Ӧ����
B.��طŵ���̵�������Ӧʽ�� O2 + 2H2O + 4e�� = 4OH��
C.�Ƚ�Mg��Al���ֽ�����������أ������۱�������֮����8��9
D.Ϊ��ֹ����������Mg(OH)2���˲������Ե���ʼ������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���R�Ǻϳ�ijҩ����м��壬�ṹ��ʽΪ![]() ������˵����ȷ����
������˵����ȷ����
A.R��M(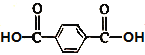 )��Ϊͬ���칹��B.R������̼ԭ��һ������ͬһƽ��
)��Ϊͬ���칹��B.R������̼ԭ��һ������ͬһƽ��
C.R����Ԫ���ϵ�һ�ȴ�����4��D.R�ܷ���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������İ���ͭ����([Cu(NH3)4]SO4��H2O)������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
I.CuSO4��Һ���Ʊ�
�ٳ�ȡ4gͭ�ۣ���A����������10���Ӳ����Ͻ��裬������ȴ��
�����������м���30mL 3mol/L�����ᣬ��A�й��������������У����Ȳ����Ͻ��衣
�۳��ȹ��˵���ɫ��Һ��
(1)A����������Ϊ_____________��
(2)ijͬѧ��ʵ������1.5g��ͭ��ʣ�࣬��ͬѧ���Ƶõ�CuSO4��Һ������һ�������м���Ũ�����о�Ĥ���֣���ȴ�����ľ����к��а�ɫ��ĩ���Խ�����ԭ��_____��
II.������Ʊ����������Ʊ���CuSO4��Һ����ͼ��ʾ���в���
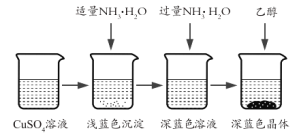
(3)��֪dz��ɫ�����ijɷ�ΪCu2(OH)2SO4����д�����ɴ˳��������ӷ�Ӧ����ʽ___________��
(4)��������ʱ���ü����Ҵ��ķ�����������Ũ���ᾧ��ԭ����_______________��
III.�������IJⶨ����ȷ��ȡmg���壬������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ���VmL10%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������������ˮ��ϴ�����ڱڣ���V1mLClmol/L���������Һ��ȫ���ա�ȡ�½���ƿ����C2mol/L NaOH����Һ�ζ���ʣ��HCl(ѡ�ü�����ָʾ��)�����յ�ʱ����V2mLNaOH��Һ��
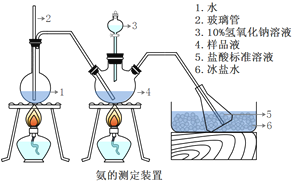
(5)������2������_________________����Ʒ�а������������ı���ʽ_______��
(6)����ʵ���������ʹ�������ⶨ���ƫ�͵�ԭ����______________��
A.�ζ�ʱδ��NaOH����Һ��ϴ�ζ���
B.����ʱ���ζ�ǰƽ�ӣ��ζ�����
C.�ζ�������ѡ�÷�̪��ָʾ��
D.ȡ�½���ƿǰ��δ������ˮ��ϴ�������ƿ�еĵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϵͳ����д�������������ƻ�ṹ��ʽ
��1��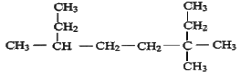 _________��
_________��
��2��˳��2����ϩ�Ľṹ��ʽΪ��____________��
��3��ʵ������ȡ��Ȳ�Ļ�ѧ����ʽΪ��_____________��
��4���Ҵ�����ȥ��Ӧ��_____________��
��5��3-��-1-��ϩ��_____________��
��6��2��2��3��3-�ļ����飺____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������㷺����ұ�𡢻�������ҵ�������Ͻ����Ӽ������������ʯ�;����õĴ����ȡ�Ϊ�������ú���������������һ�����÷ϴ���������V2O5��VOSO4�������Թ����Σ�����V2O5���¹����������£�
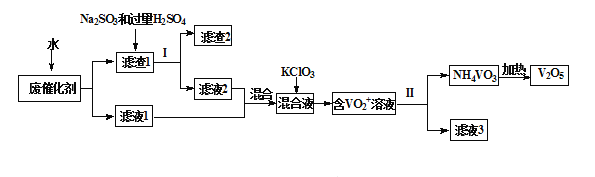
��֪��a.���ֺ������ʳ�������ˮ�е��ܽ������±���ʾ��
���� | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
�ܽ��� | ���� | ���� | ���� | ���� |
b.![]() +2OH-
+2OH-![]()
![]() +H2O
+H2O
�ش��������⣺
��1����ˮ���ݷϴ�����Ϊ����ߵ�λʱ���ڷϷ��Ľ����ʣ����Բ�ȡ�Ĵ�ʩΪ_________��дһ������
��2����Һ1����Һ2�з��Ĵ�����ʽ��ͬ���������ʽΪ_______________�������ӷ��ţ���
��3��������1�м���Na2SO3����H2SO4��Һ������Ӧ�Ļ�ѧ����ʽΪ_____________��
��4������VO2+�ķ�Ӧ������1molKClO3ʱת��6mol���ӣ��÷�Ӧ�����ӷ���ʽΪ________________
��5����ϻ�ѧ�����ƽ���ƶ�ԭ�����ͼ��백ˮ��һ������Ϊ__________________
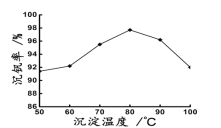
��6�������NH4VO3����ʽ�����������Գ����ʣ�NH4VO3������V�������ͷϴ���V������֮�ȣ���ʾ�ò���Ӧ���Ļ����ʡ��������ͼ�¶ȳ���80���Ժ������½��Ŀ���ԭ����________________________��___________________��д��������
��7���ù��������п���ѭ�����õ�����Ϊ__________________��
��8���ⶨ��Ʒ��V2O5�Ĵ��ȣ���ȡa g��Ʒ�����������ܽ⣬�õ�(VO2)2SO4��Һ���ټ���b1 mL c1 mol��L1 (NH4)2Fe(SO4)2��Һ��VO2++2H++Fe2+==VO2++Fe3++H2O���������c2 mol��L1 KMnO4��Һ�ζ�������(NH4)2Fe(SO4)2���յ㣬����KMnO4��Һ�����Ϊb2 mL����֪����ԭΪMn2+���������ʲ����뷴Ӧ�����Ʒ��V2O5��Ħ��������182 g��mol1��������������______�����г�����ʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com