
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
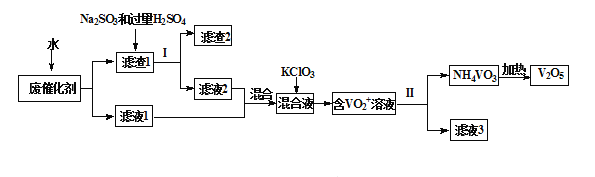
已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.![]() +2OH-
+2OH-![]()
![]() +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为_________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_______________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为_____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为________________
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__________________
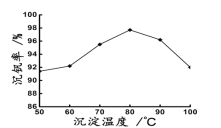
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是________________________;___________________(写两条)。
(7)该工艺流程中可以循环利用的物质为__________________。
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol1)的质量分数是______。(列出计算式)
【答案】粉碎废钒搅拌适当升温 VO2+ V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O 6VO2++ClO3-+3H2O= 6VO2++Cl-+6H+ 作用1:溶液中存在平衡: VO2++2OH—![]() VO3—+H2O,加入氨水,使OH—浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3- 作用2:溶液中存在平衡: NH4VO3(s)
VO3—+H2O,加入氨水,使OH—浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3- 作用2:溶液中存在平衡: NH4VO3(s) ![]() NH4+ (aq)+ VO3-(aq), 加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出 原因1:温度升高,NH4VO3溶解度增大,沉钒率下降。 原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降。 氨水或NH3和H2O
NH4+ (aq)+ VO3-(aq), 加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出 原因1:温度升高,NH4VO3溶解度增大,沉钒率下降。 原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降。 氨水或NH3和H2O ![]()
【解析】
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以用搅拌、粉碎的方式来增大固体与液体的接触面积,也可以升高温度;
(2)由部分含钒物质常温下在水中的溶解性可知,滤液1溶质为VOSO4;
(3)滤液1和滤液2中钒的存在形式相同,所以V2O5与亚硫酸钠、硫酸反应生成VOSO4;
(4)KClO3与VO2+反应生成V2O5,ClO3-作氧化剂,根据1molKClO3在反应时得到6mol电子,ClO3-被还原为Cl-;
(5)根据勒夏特列原理解释加入氨水的作用;
(6)从NH4VO3的溶解度、以及氨水受热分解的角度分析;
(7)NH4VO3受热分解生成V2O5、氨气、水,故可以循环的物质是氨水;
(8)根据元素化合价升降相等,滴定过程中由5(NH4)2Fe(SO4)2~KMnO4,则过量的(NH4)2Fe(SO4)2物质的量为5n(KMnO4)=5×b2c2×10-3mol,则与(VO2)2SO4溶液反应的(NH4)2Fe(SO4)2物质的量为(b1c1-5×b2c2)×10-3mol,根据钒元素守恒,则与V2O5 ~2VO2+~(NH4)2Fe(SO4)2,故n(V2O5)=5×(b1c1-5×b2c2)×10-4mol,据此计算可得。
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取粉碎废钒、搅拌、适当升温等措施;
(2)由部分含钒物质常温下在水中的溶解性可知,滤液1溶质为VOSO4,滤液1和滤液2中钒的存在形式相同,其存在形式为VO2+;
(3)滤渣1的成分为V2O5、不溶性硅酸盐,因为滤液1和滤液2中钒的存在形式相同,所以滤渣1的成分中的V2O5与与亚硫酸钠、硫酸反应生成VOSO4,发生反应的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O;
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,故ClO3-被还原为Cl-,反应的离子方程式为6VO2++ClO3-+3H2O= 6VO2++Cl-+6H+;
(5)含VO2+的溶液中加入氨水生成NH4VO3,用平衡移动原理解释其作用,作用1![]() VO3-+H2O,加入氨水,使OH—浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-,作用2:溶液中存在平衡: NH4VO3(s)
VO3-+H2O,加入氨水,使OH—浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-,作用2:溶液中存在平衡: NH4VO3(s) ![]() NH4+ (aq)+ VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;
NH4+ (aq)+ VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;
(6)温度超过80℃以后,沉钒率下降的原因:①温度升高,NH4VO3溶解度增大,沉钒率下降;②温度升高,氨水受热分解逸出溶液,氨气在水中的溶解度降低,使NH4+浓度下降,沉钒率下降;
(7)NH4VO3受热分解的方程式为2NH4VO3![]() V2O5+2NH3+H2O,故该工艺流程中可以循环利用的物质为NH3和H2O;
V2O5+2NH3+H2O,故该工艺流程中可以循环利用的物质为NH3和H2O;
(8)根据元素化合价升降相等,滴定过程中由5(NH4)2Fe(SO4)2~KMnO4,则过量的(NH4)2Fe(SO4)2物质的量为5n(KMnO4)=5×b2c2×10-3mol,则与(VO2)2SO4溶液反应的(NH4)2Fe(SO4)2物质的量为(b1c1-5×b2c2)×10-3mol,根据钒元素守恒,则与V2O5 ~2VO2+~(NH4)2Fe(SO4)2,故n(V2O5)=5×(b1c1-5×b2c2)×10-4mol,则产品中V2O5 的质量分数是: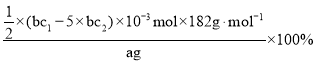 =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】某黄色溶液中可能含有Na+、NH4+、Fe2+、Fe3+、Cl﹣、SO42﹣、CO32﹣等离子(不考虑水的电离和离子的水解)。某同学为了确定其组分,设计并完成了如下实验:
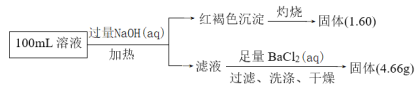
下列说法正确的是( )
A.c(Fe3+)一定为0.2molL﹣1
B.Cl﹣一定存在
C.Na+、SO42﹣一定存在,NH4+一定不存在
D.Na+、Fe2+可能存在,CO32﹣一定不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图所示化合物的说法不正确的是 ( )
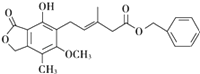
A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与1molNa反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.25℃时 pH=2 的 HF 溶液中,由水电离产生的 OH-浓度为 10-12 mol·L-1
B.0.1 mol·L-1 Na2CO3 溶液中:c(Na+)=c(HCO3 -)+c(H2CO3)+2c(CO32- )
C.向 1 L 1 mol·L-1 的 NaOH 热溶液中通入一定量 Br2,恰好完全反应生成溴化钠、次溴酸钠和溴酸钠(溴 酸为强酸、次溴酸为弱酸)的混合溶液:c(Na+)+c(H+)=6c(BrO3-)+2c(BrO-)+c(HBrO)+c(OH-)
D.25℃时 pH=3 的盐酸与 pH=11 的氨水等体积混合,所得溶液的 pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在实验室进行氨的快速制备与性质探究实验的组合装置,部分固定装置未画出。

(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先________________,打开弹簧夹1,在E中装入水,然后微热A,观察到E中有气泡冒出,移开酒精灯,E中导管内有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗活塞,稍等片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生_______(答现象);从E中逸出液面的气体可以直接排入空气中,请写出在C中发生反应的化学方程式:_________________________________________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16g,反应后固体质量减少2.4g,通过计算确定该固体产物的成分:________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:______________________,迅速产生倒吸的原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 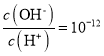 的溶液:NH4+、Cu2+、NO3-、SO42-
的溶液:NH4+、Cu2+、NO3-、SO42-
B.0.1 mol·L1的氨水:Cu2+、Na+、SO42-、NO3-
C.1 mol·L1的NaClO溶液:Fe2+、Al3+、NO3-、I
D.0.1 mol·L1的NaHCO3溶液:K+、Na+、NO3-、OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
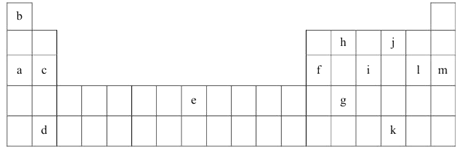
(1)上述元素的单质可能是电的良导体的是_______(填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
锂 | X | Y | |
第一电离能 | 519 | 502 | 580 |
第二电离能 | 7296 | 4570 | 1820 |
第三电离能 | 11799 | 6920 | 2750 |
第四电离能 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:______________________________________。
②表中的Y可能为以上13种元素中的_________(填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式___________________________。
(3)根据构造原理,用电子排布式表示e的核外电子排布式_______________。
(4)以上13种元素中,________(填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______(用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯是一种新型抗炎、解热、镇痛药,其结构如下所示。下列对该化合物叙述正确的是
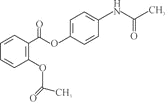
A. 贝诺酯分子式为![]()
B. 贝诺酯属于芳香烃
C. 贝诺酯属于高分子化合物
D. 已知贝诺酯的水解产物之一为对氨基乙酰酚(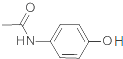 ),在核磁共振氢谱中,对氨基乙酰酚有5种峰
),在核磁共振氢谱中,对氨基乙酰酚有5种峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料。回答下列问题:
(1)基态硒原子的核外电子排布式为[Ar]__________,核外电子占据的最高能层的符号是________________。
(2)砷与锗、硒是同周期主族元素,该三种元素的第一电离能由大到小的顺序为_______________________。
(3)单晶锗具有金刚石结构,其原子之间存在的作用力为__________________。
(4)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是____________。硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为_______________,丁硅烯(Si4H8)中![]() 键与
键与![]() 键个数之比为______________。
键个数之比为______________。
(5)已知GaCl3的熔点77. 9 °C ,沸点201°C ; GeCl4的熔点 -49. 5 °C ,沸点84 °C,则GaCl3的晶体类型为______________,GaCl3的杂化轨道类型为_____________,GeCl4的空间构型为_________________。
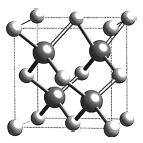
(6)砷化稼的晶胞结构如图所示,若该晶体密度为![]() ]则晶胞参数a =_____________cm (用NA表示阿伏加德罗常数)。
]则晶胞参数a =_____________cm (用NA表示阿伏加德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com