
【题目】(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
![]()
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .

(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
【答案】(1)1(1分),4:3(2分);(2)3:1(2分);
(3)2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+(2分);
(4)阳极(2分),2H++2HSO3-+2e-=S2O42-+2H2O(2分);
(5)NO2-的浓度为ag/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:![]() .设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒解得V=243a.
.设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒解得V=243a.
【解析】试题分析:(1)①在反应NO +O3=NO2+O2中,每产生1mol 的氧气,转移电子的物质的量是2mol,现在生成标准状况下11.2 L O2时,n(O2)=0.5mol,所以转移电子的物质的量是1mol。②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,反应方程式是:6NO2+4 CO(NH2)2=7N2+4CO2+8H2O,在该反应中,NO2是氧化剂,变为还原产物N2;CO(NH2)2是还原剂,变为氧化产物N2,所以氧化产物与还原产物的质量比为8:6=4:3。(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则根据电子守恒及原子守恒,可得方程式:3CO+2 NOx →N2+3CO2,化学方程式中CO2和N2的化学计量数比,3:1;(3)在酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,根据电子守恒、电荷守恒、原子守恒可得生成等物质的量的NO3-和NO2-时的离子方程式是2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;(4)用质子交换膜电解槽电解Ce3+使得Ce4+再生,再生时Ce3+失去电子,被氧化,所以生成的Ce4+在电解槽的阳极,同时在另一极发生还原反应生成S2O42一,反应的电极反应式为2H++2HSO3-+2e-=S2O42-+2H2O;(5)在进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,NO2-的浓度为ag/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:![]() .设消耗标况下氧气的体积是V,设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒
.设消耗标况下氧气的体积是V,设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒![]() = V÷22.4×2×(2-0)。解得V=243a.
= V÷22.4×2×(2-0)。解得V=243a.


科目:高中化学 来源: 题型:
【题目】(1)CH3COOH是最常见的有机弱酸。
①CH3COOH的电离方程式为_____________。
②CH3COONa溶液呈碱性,原因是__________(填“CH3COO-”或“Na+”)水解引起的。
③ 在CH3COONa溶液中,c(Na+)_______c(CH3COO-)、(填“>”“=”或“<”)
(2)已知:反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=131.3kJ/mol
CO(g)+H2(g)的△H=131.3kJ/mol
① 该反应是反应__________(填“吸热”或“放热”)。
② 若反应消耗24gC(s),则反应的热效应为__________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16 mol 通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
① 2 min 内,vCO=__________。
② 该温度下,此反应的平衡常数表达式K=_________。
③ 其他条件不变,再充入0.1molCO和0.1molH2O(g),达到平衡时CO 的休积分数_____(填“增大”、“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
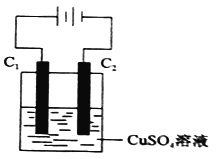
① C1作_________(填“阳极”或”阴极”)。
② C2极电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)

(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )
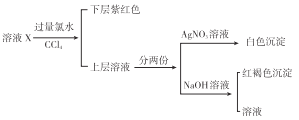
A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三种有机物是某些药物中的有效成分,以下说法中正确的是( )

A. 三种有机物都能与浓溴水发生反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多
D. 只用FeCl3溶液就能鉴别出这三种有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
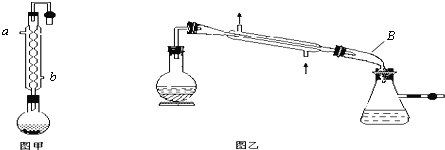
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__________,目的是__________。
(2)反应中加入过量的乙醇,目的是__________________________。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴
加乙酸边加热蒸馏。这样操作可以提高酯的产率,其原因是____________________。
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:

则试剂a是:____________,分离方法I是____________,分离方法II是____________,
试剂b是______________,分离方法III是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不饱和酯类化合物在药物、涂料等领域应用广泛。(6分,每空1分)

Ⅰ
(1)下列化合物Ⅰ的说法,正确的是 。
A.遇FeCl3溶液可能显紫色
B.可发生酯化反应和银镜反应
C.能与溴发生取代和加成反应
D.1 mol化合物Ⅰ最多能与2 mol NaOH反应
(2)反应①是一种由烯烃直接制备不饱和酯的新方法:

化合物Ⅱ的分子式为 ,1 mol化合物Ⅱ能与 mol H2恰好完全反应生成饱和烃类化合物。
(3)化合物Ⅱ可由芳香族化合物Ⅲ或Ⅳ分别通过消去反应获得,但只有Ⅲ能与Na反应产生H2,Ⅲ的结构简式为 (写1种);由Ⅳ生成Ⅱ的反应条件为 。
(4)聚合物![]() 可用于制备涂料,其单体结构简式为________________。
可用于制备涂料,其单体结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中发生下列反应∶2HI(g)![]() H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
A.等于15s B.等于10 s C.大于10s D.小于10 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com