
| △C |
| △t |
| 1 |
| 20 |
| △C |
| △t |
| 1 |
| 20 |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
| A、42% | B、58% |
| C、36% | D、64% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧杯中有铜无铁 |
| B、烧杯中有铁无铜 |
| C、烧杯中铁铜都有 |
| D、烧杯中铁铜都无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32 |
| D、含有大量OH-的无色溶液中:Na+、Cu2+、AlO2-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、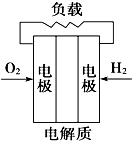 |
C、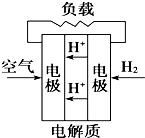 |
D、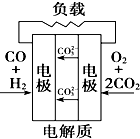 |
查看答案和解析>>
科目:高中化学 来源: 题型:
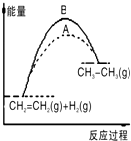
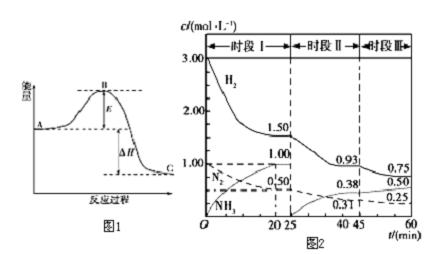
| A、在一定条件下,某可逆反应的△H=+100kJ?mol-1,则该反应正反应活化能比逆反应活化能大100kJ?mol-1 |
| B、图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0未使用和使用催化剂时,反应过程中的能量变化 |
| C、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| D、如图所示的能量变化判断该化学反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸 |
| B、将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8 |
| C、用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
| D、ph=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W、X、Y形成的简单离子半径大小关系为W>X>Y |
| B、M、W元素形成的简单氢化物的沸点:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com