
| A. | ②④⑥ | B. | ①④⑥ | C. | ②④⑤ | D. | 全部 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,二氧化氮浓度不变,混合气体的颜色不变,据此分析解答.
解答 解:①2V(O2)=V(NO2)的状态正逆反应速率不一定相等,不一定是平衡状态,故错误;
②单位时间内生成n mol O2,同时生成2n molNO2,说明反应v正=v逆,达到平衡状态,故正确;
③NO2、NO、O2的浓度之比为2:2:1的状态不能说明反应v正=v逆,不一定达到平衡状态,故错误;
④混合气体的颜色不再改变,说明NO2气体的浓度不变,达到平衡状态,故正确;
⑤无论反应是否达到平衡状态,混合气体的质量不变,容器的体积不变,所以混合气体的密度不变,不能说明达到平衡状态,故错误;
⑥混合气体的平均相对分子质量等于质量和物质的量的比值,混合气体的质量不变,物质的量变化,所以混合气体的平均相对分子质量不变,能说明达到平衡状态,故正确.
故选A.
点评 本题考查化学平衡状态的判断,难度不大,做题时注意分析化学方程式的前后计量数大小的关系.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
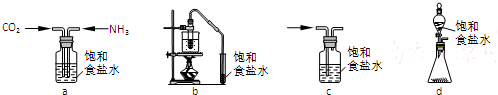
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg3N2+H2O═3Mg(OH)2+2NH3↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | 2NaOH+Cl2═NaCl+NaClO+H2O | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
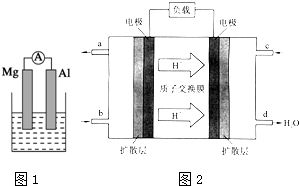 据图回答下列问题:
据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只能是离子化合物X2Y | |
| B. | 只能是共价化合物X2Y2 | |
| C. | 既可能是离子化合物也可能是共价化合物 | |
| D. | 形成的化合物无论是X2Y还是X2Y2 原子都达到了8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应结束后溶液的pH:甲>乙 | |
| B. | 反应开始时的速率:甲>乙 | |
| C. | 反应所需时间:甲<乙 | |
| D. | 反应开始时,酸的物质的量浓度:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应可以设计成原电池来提供电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:K+、NH4+、NO3-、HCO3- | |
| B. | 能使甲基橙变红的溶液中:Na+、K+、SO42-、AlO2- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液中:H+、Ca2+、SCN-、Cl- | |
| D. | 0.1mol•L-1AlCl3溶液中:Cu2+、Mg2+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com