
铁做为重要的金属元素与人类生产生活密切相关,某课外活动小组在学习了氧化剂和还原剂后,要利用实验验证铁及其化合物的性质。
请你帮助他们完成以下实验报告:
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片
(3)仪器:胶头滴管, (你认为本实验必不可少的一种玻璃仪器)。
(4)实验记录(虚线部分不必填写)
序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=Zn2++Fe | ||
③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 | |
④ | 溶液由黄色变为蓝色 | Fe3+具有氧化性 |
(5)实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
①根据以上结论判断,下列物质中既有氧化性,又有还原性的有: (填序号)。
A Cl2 B Na C Na+ D Cl- E NO2
②亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该加入少量 防止亚铁盐被氧化。
科目:高中化学 来源:2015-2016学年江西省高二上学期12月月考化学试卷(教师版) 题型:填空题
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子方程式表示)________________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是___________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是__________________________(请用反应的离子方程式表示)。
(4)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
(a)在加水稀释HA溶液的过程中, 随着水量的增加而增大的是 (填字母)。
随着水量的增加而增大的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(b)NaA溶液显________(填“酸性”、“中性”或“碱性”),
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期末热身理综化学试卷(解析版) 题型:选择题
紫苏醇的结构简式如右图所示。下列有关紫苏醇的说法正确的是
A.与乙醇互为同系物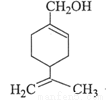
B.一定条件下能与乙酸发生酯化反应
C.存在属于芳香族化合物的同分异构体
D.能与溴水、酸性高锰酸钾溶液发生加成反应
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:填空题
某学习小组依据反应:SO2(g)+ Cl2(g)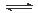 SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2 | Cl2 | SO2 | |
熔点/℃ | –54.1 | –101 | –72.4 |
沸点/℃ | 69.1 | –34.6 | –10 |
性质 | 遇水发生剧烈水解 |
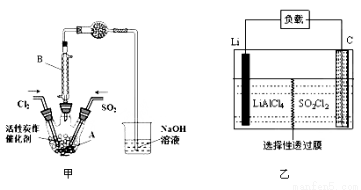
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6) GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期末模拟化学试卷(解析版) 题型:选择题
某溶液中含有大量的下列离子:X离子、NH4+、Cl-和Al3+,经测定X离子、NH4+、Cl-和Al3+的物质的量浓度之比为2∶1∶5∶2,则X离子可能是
A.OH- B.Na+ C.NO3- D.Ag+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:填空题
合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6 L NH3时,放出的热量为________。
2NH3(g) ΔH=-92.2 kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6 L NH3时,放出的热量为________。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示。由图可知:

①温度T1、T2时的平衡常数分别为K1、K2,则K1__________K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡__________移动(填“向左”、“向右”或“不”)。
②见右图,T2温度时,在1 L的密闭容器中加入2.1 mol N2、1.5 mol H2,经10 min达到平衡,则v(H2)=________mol/ (L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4 mol,则平衡________移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(l)+CO(NH2)2(l) ΔH,在一定压强下测得如下数据:
H2O(l)+CO(NH2)2(l) ΔH,在一定压强下测得如下数据:

①则该反应ΔH______0,表中数据a______d,b______f(均选填“>”、“=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:选择题
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42﹣═2PbSO4+2H2O.下列有关说法正确的是

A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,Pb上发生反应为:Pb-2e- = Pb2+
C.K与M连接时,所用电源的a极为负极
D.K与M连接时,PbO2上发生反应为:PbO2+4e_+4H++SO42﹣═PbSO4+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
下列表示氯及其化合物的化学用语正确的是
A.中子数为20的氯原子符号:20Cl
B.HClO的结构式:H—Cl—O
C.HClO4的电离方程式:HClO4 H++ClO4-
H++ClO4-
D.Cl-的结构示意图:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上学期12月月考化学试卷(解析版) 题型:选择题
下列各种情况下一定能大量共存的离子组为
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO、Cl-、K+
C.pH=1的溶液中:NH、Cl-、Cu2+、SO
D.无色溶液中:Al3+、HCO、I-、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com