
【题目】对羟基苯甲醛,俗称PHBA,是一种重要的有机化工原料。其结构为![]() 。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:

![]() CH3OCH3
CH3OCH3
![]() C
C
![]() D
D![]() E
E![]() PHBA
PHBA
已知:![]()
(1)PHBA的官能团的名称为________。
(2)下列有关PHBA的说法正确的是________。
A.PHBA的分子式为C7H6O2
B.PHBA是一种芳香烃
C.1 mol PHBA最多能与4 mol H2反应
D.PHBA能与NaHCO3溶液反应生成CO2
(3)上述反应中属于取代反应的是________。
(4)反应③的化学方程式为____________________________。
(5)该合成途径中的反应①⑤的作用为_________________。
(6)E有多种同分异构体,符合以下所有特征的同分异构体的结构简式为__________________(只写一种)。
a.苯环上存在2种不同化学环境的氢原子,且个数比为1∶2
b.遇FeCl3溶液显示特征颜色
c.能使溴的四氯化碳溶液褪色
【答案】 羟基、醛基 AC ①②③⑤  +NaOH
+NaOH![]()
 +NaCl 保护酚羟基,防止其被氧化
+NaCl 保护酚羟基,防止其被氧化 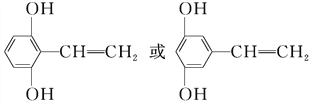
【解析】(1)根据PHBA的结构简式,可知含有的官能团有:羟基、醛基;
(2)A.根据PHBA的结构可知,其分子式为C7H602 ,故A正确;B.烃只含有C、H两种元素,而PHBA中还含有O元素,不属于芳香烃,故B错误;C.苯环与醛基都能与氢气发生加成反应,故1molPHBA需要4mol氢气,故C正确;D.酚羟基不能与碳酸氢钠反应,故D错误,故答案为AC;
(3)由反应物及生成物的结构可知,反应①为取代反应, 与氯气在光照条件下发生取代反应生成C为
与氯气在光照条件下发生取代反应生成C为 ,C发生水解反应生成D为
,C发生水解反应生成D为 ,D氧化生成E为
,D氧化生成E为![]() ,E发生水解反应得到
,E发生水解反应得到![]() ,故属于取代反应的有:①②③⑤;
,故属于取代反应的有:①②③⑤;
(4)反应③的化学方程式为: ;
;
(5)由于酚羟基易被氧化,反应①⑤的作用为保护酚羟基,防止其被氧化;
(6)E为![]() ,其同分异构体符合以下所有特征:遇FeCL3溶液显示特征颜色,说明含有酚羟基,能使溴的四氯化碳溶液褪色,含有不饱和键,且苯环上存在2种不同化学环境的氢原子,且个数比为1:2,应含有3个取代基,符合条件的同分异构体有:
,其同分异构体符合以下所有特征:遇FeCL3溶液显示特征颜色,说明含有酚羟基,能使溴的四氯化碳溶液褪色,含有不饱和键,且苯环上存在2种不同化学环境的氢原子,且个数比为1:2,应含有3个取代基,符合条件的同分异构体有:![]() 或
或 。
。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+)D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能__________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全。
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-34 | 10-16 | 10-38 |
(3)滤渣B的成分是_____________________.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为____________________.
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为________________________________________________.
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1 Na2S2O3溶液反应(I2+2S2O32-====2I—+S4O62—)。计算可得该样品纯度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应曾用于检测司机是否酒后驾驶:2Cr2O![]() +3CH3CH2OH+16H++13H2O―→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O―→4[Cr(H2O)6]3++3CH3COOH
(1)CH3COOH中C原子轨道杂化类型为_______________________________;
1 mol CH3COOH分子含有σ键的数目为________。
(2)与H2O互为等电子体的一种阳离子为________(填化学式);H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. SiO2、NO、SO2、SO3属于非金属氧化物,又属于酸性氧化物
B. NH3形成铵盐的过程属于氮的固定
C. 纯铁的熔点比生铁低
D. 可以用光洁无锈的铁丝代替铂丝作焰色反应实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是工业上常用的化工原料,可以用于合成安息香酸苄酯和高分子化合物G(部分反应条件略去),流程如下所示,请回答下列问题:

(1)C的化学名称是______,E分子中最多有______个原子共平面。
(2)C生成D的反应类型为______。
(3)A生成E的化学方程式为___________。
(4)CH2=CH-CH=CH2也可以反应生成高分子化合物,而且是合成橡胶的重要原料,下列橡胶中一定不能以其为主要初始原料获得的是_____。
①丁苯橡胶 ②顺丁橡胶 ③硅橡胶胶 ④乙丙橡胶 ⑤丁腈橡胶
(5)H是D的同分异构体,分子中含有酯基,有两个苯环且不直接相连,符合上述条件的结构有____种(不包括D),其中核磁共振氢谱图有6组峰,且面积比为3:2:2:2:2:l的同分异构体的结构简式为________(写出一种即可)。
(6)今照上述合成路线,以2-氯丙烷为原料,设计2-甲基-2-丙醇的最佳合成路线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________(写一种方法即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
A. 9种 B. 6种 C. 5种 D. 4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com