
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,S、O、N三种元素的电负性由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2,CN中提供孤电子对的原子是______,1 mol CN中含有的π键的数目为_________。与CN互为等电子体的离子有_________ (写出一种即可)。
(3)已知AlCl3的蒸气是缔合的双分子(Al2Cl6),更高温度下Al2Cl6则离解生成AlCl3单分子。单分子AlCl3的立体构型是________,缔合双分子Al2Cl6中Al原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_____。
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为d nm,则该合金的密度为____________ g/cm3 (不必化简,用NA表示阿伏加德罗常数)。

【答案】 [Ar]3d9 或 1s22s22p63s23p63d9 O>N>S N 2NA 或 2×6.02×1023 C22- 平面三角形 sp3 氧化镁晶体所含离子半径小,电荷多,晶格能大 Mg2Fe 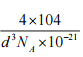
【解析】试题分析:(1)Cu2+核外有27个电子,根据核外电子排布规律写电子排布式。非金属性越强电负性越大。
(2)CN中N原子含有孤对电子,CN-存在C、N叁键,叁键中有2个π键。等电子体是原子数相同、价电子数相同的分子或离子。
(3)根据氯化铝结构判断空间结构、原子杂化类型。
(4)离子化合物的熔点与离子半径和电荷多少有关。
(5)根据均摊原则分析铁镁合金的化学式,根据![]() 计算合金的密度。
计算合金的密度。
解析:(1)Cu2+核外有27个电子,根据核外电子排布规律,基态Cu2+的电子排布式是[Ar]3d9 。非金属性越强电负性越大,所以S、O、N三种元素的电负性由大到小的顺序为O>N>S。
(2)CN中N原子含有孤对电子,CN中提供孤电子对的原子是N,CN-存在C、N叁键,叁键中有2个π键,1 mol CN含有的π键是2mol,数目为2×6.02×1023。等电子体是原子数相同、价电子数相同的分子或离子,与CN互为等电子体的离子有C22-。
(3)氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3。
(4)离子化合物的熔点与离子半径和电荷多少有关,氧化镁晶体所含离子半径小,电荷多,所以晶格能大。
(5)根据均摊原则晶胞中铁原子数![]() =4,镁原子数8,,铁镁合金的化学式是Mg2Fe,设有1mol晶胞,体积为
=4,镁原子数8,,铁镁合金的化学式是Mg2Fe,设有1mol晶胞,体积为![]() ,质量为104
,质量为104![]() ,根据
,根据![]() ,合金的密度是
,合金的密度是![]()


科目:高中化学 来源: 题型:
【题目】在相同条件下,总质量为2 g的CO和H2的混合气体,在O2中完全燃烧后全部通过足量的Na2O2固体,则固体质量增加( )
A. 2 g B. 1 g C. 18 g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】春秋战国时期青铜器的制作达到鼎盛,问鼎、晋爵和炉火纯青等词汇的出现均与青铜器的发展息息相关.同时,冶铁术也开始发展,传说中的雌雄名剑“干将”和“莫邪”就是当时的一对铸剑夫妇用生铁等铸成,青铜鼎和雌雄双剑均为( )
A. 合金 B. 混合物 C. 化合物 D. 纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 水晶顶链是硅酸盐制品 B. 臭氧可作为自来水消毒剂
C. 漂白粉可作环境和游泳池的消毒剂 D. 硅胶可作为食品的干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.常温下pH=7的溶液中:Fe3+、Mg2+、![]() 、Cl能大量共存
、Cl能大量共存
B.在含有0.1 mol·L1 Fe3+的溶液中:SCN、Cl、K+不能大量共存
C.在含有![]() 、
、![]() 、S2、CH3COO四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO浓度变化最小
、S2、CH3COO四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO浓度变化最小
D.常温下,水电离出c(H+)=1010的溶液中:Na+、ClO、S2、![]() 不能大量共存
不能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为___________⑧ ⑤__________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有 _______________________________。
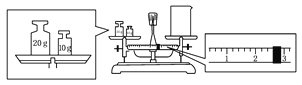
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为_________ g,要完成本实验该同学应称出_________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,下列操作会引起浓度偏低的是________。
①没有洗涤烧杯和玻璃棒且未将洗涤液注入容量瓶
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键线式是有机物结构的表示方法之一,碳链用线段表示,氢原子省略不写,如图所示是药物异搏定合成路线中的某一步反应,下列说法正确的是( )

A. 物质X的化学式为C7H6O2
B. 物质Y中含有一个手性碳原子
C. 物质Z中在同一平面内最多的碳原子可能有13个
D. 物质Z含有两种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.氯气通入水中:Cl2 + H2O ![]() 2H+ + Cl-+ClO-
2H+ + Cl-+ClO-
B.AgCl溶于氨水:AgCl+2NH3·H2O=[Ag(NH3)2]++Clˉ+2H2O
C.向NaAlO2溶液中通入过量的CO2:2AlO![]() +CO2+3H2O=2Al(OH)3↓+CO32-
+CO2+3H2O=2Al(OH)3↓+CO32-
D.用稀硝酸除去试管内壁银:Ag+ 2H+ + NO3- = Ag+ + NO2↑ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式: 试剂X :___ ,沉淀A:____ ,沉淀B:___ 。
(2)按此实验方案得到的溶液3中肯定含有______ (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com