
分析 氯气具有强氧化性,铁具有还原性,氯化亚铁中亚铁离子具有还原性,Cl2与FeCl2溶液反应生成FeCl3,铁粉与FeCl3反应生成FeCl2,据此分析.
解答 解:Cl2与FeCl2溶液反应生成FeCl3,其反应的化学方程式为:2FeCl2+Cl2=2FeCl3;铁粉与FeCl3反应生成FeCl2其反应的化学方程式为:2FeCl3+Fe=3FeCl2;根据两个反应可知,处理过程中消耗的原料是铁粉,
故答案为:2FeCl2+Cl2=2FeCl3;2FeCl3+Fe=3FeCl2;Fe粉.
点评 本题考查了Fe与FeCl3和FeCl2之间的转化,题目难度不大,注意根据得失电子守恒和原子守恒配平.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
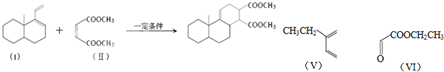
 .
. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下67.2 L乙烯所含的碳碳双键数与78 g苯所含的碳碳双键数 | |
| B. | 18g重水(D2O)与20g Ne含有相等的电子数 | |
| C. | 1mol CaC2与78 g Na2O2两种固体所含的阴、阳离子总数相等 | |
| D. | 在平衡体系PCl5(g)?PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后,37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素化合价升高的反应是还原反应 | |
| B. | 物质在变化中失去了电子,此物质中的某一元素化合价降低 | |
| C. | 有电子转移的反应就是氧化还原反应 | |
| D. | 有化合价升降的反应,不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11mol H2反应 | |
| C. | 2,5羟基苯乙酮能发生加成、氧化、还原、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com