
分析 CH3COOH是弱电解质,部分电离生成CH3COO-、H+;
(1)加入冰醋酸,醋酸浓度增大平衡向正反应方向移动;
(2)浓度越小其电离程度越大;但其电离增大程度小于溶液体积增大程度;
(3)HCl电离出的氢离子抑制醋酸电离;
(4)加入氯化钠溶液相当于稀释醋酸,促进醋酸电离.
解答 解:CH3COOH是弱电解质,部分电离生成CH3COO-、H+,电离方程式为CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
(1)加入冰醋酸,醋酸浓度增大平衡向正反应方向移动,导致溶液中c(H+)增大,
故答案为:向电离方向移动;增大;
(2)浓度越小其电离程度越大,所以加水稀释促进醋酸电离,平衡向电离方向移动;但其电离增大程度小于溶液体积增大程度,导致溶液中c(H+)减小,
故答案为:向电离方向移动;减小;
(3)HCl电离出的氢离子抑制醋酸电离,所以抑制醋酸电离,则醋酸向离子结合成分子的方向移动,但溶液中c(H+)增大,
故答案为:向离子结合成分子的方向移动;增大;
(4)加入氯化钠溶液相当于稀释醋酸,促进醋酸电离,则醋酸向电离方向移动,因为醋酸电离增大程度小于溶液体积增大程度,所以c(H+)减小,
故答案为:向电离方向移动;减小.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点及电离影响因素是解本题关键,知道弱电解质电离程度与其浓度关系,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 大量的汽车尾气是造成雾霾天气的一个重要因素 | |
| D. | 煤的液化和气化均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +3HNO3 $→_{△}^{浓硫酸}$
+3HNO3 $→_{△}^{浓硫酸}$ +3H2O;
+3H2O; 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
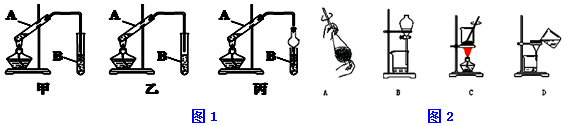
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氖原子的相对原子质量是12$\frac{a}{b}$ | B. | 该氖原子的摩尔质量是aNAg | ||
| C. | Wg该氖原子的物质的量是$\frac{W}{{a{N_A}}}$mol | D. | Wg该氖原子所含质子数是10W/a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小苏打 (NaHCO3)治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| C. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
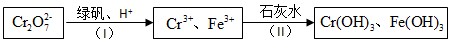
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com