
分析 (1)电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下都不能导电的化合物;例:有机物,非金属氧化物等;
物质导电的条件为:含有自由移动的离子或者电子;
(2)分清电解质强弱,强电解质完全电离,应等号,弱电解质部分电离,用可逆号,多元弱酸分步电离,多元弱酸的酸式根离子不能拆,据此解答.
解答 解:(1)①水银为单质,既不是电解质也不是非电解质; 含有自由电子,能导电;
②烧碱在水溶液中或者熔融状态下都能导电的化合物,是电解质;不含有自由移动的离子或者电子,不导电;
③硫酸钡在熔融状态下能导电的化合物,属于电解质;不含有自由移动的离子或者电子,不导电;
④氯化钠晶体水溶液中或者熔融状态下都能导电的化合物,是电解质;不含有自由移动的离子或者电子,不导电;
⑤盐酸是混合物,既不是电解质也不是非电解质; 含有自由移动的离子,能导电;
⑥蔗糖在水溶液中和熔融状态下都不能导电的化合物,属于非电解质;不含有自由移动的离子或者电子,不导电;
所以:能导电是 ①⑤,属于电解质是 ②③④,属于非电解质的是 ⑥;
故答案为:①⑤,②③④,⑥;
(2)①硫酸钠为强电解质,完全电离,电离方程式:Na2SO4═2Na++SO42-;
故答案为:Na2SO4═2Na++SO42-;
②碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-;
故答案为:NaHCO3═Na++HCO3-;
③二者反应生成硫酸钡和水,离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;
故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O.
点评 本题考查了电解质、非电解质判断,电解质电离方程式书写,明确相关概念,分清电解质强弱及电离方式是解题关键,注意电离方程式遵循客观事实,遵循原子个数守恒、电荷守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4NH3+5O2═4NO+6H2O | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2NaHCO3═Na2CO3+H2O+CO2 | D. | Cl2+2NaBr═2NaCl+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
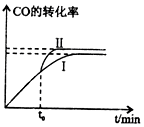 为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.
为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
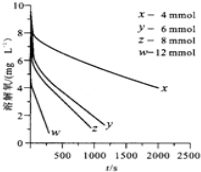
| 反应阶段 | 速率方程 | $\frac{k(297.0K)}{k(291.5K)}$ |
| 富氧区 | v=kc(SO32-)•c(O2) | 1.47 |
| 贫氧区 | v=kca(SO32-)•cb(O2) | 2.59 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com