
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
分析 A、同周期原子半径的递变规律:从左到右逐渐减小;
B、同周期气态氢化物的递变规律:从左到右热稳定性逐渐增强;
C、同周期从左到右最高价含氧酸的酸性逐渐增强、同主族从上到下最高价含氧酸的酸性逐渐减弱;
D、熔点:离子晶体高于金属晶体高于分子晶体的.
解答 解:A.同周期元素原子的半径从左到右依次减小,则原子半径:Al<Mg<Na,故A错误;
B.同周期元素气态氢化物的稳定性从左到右逐渐增强,即热稳定性:HCl>H2S>PH3,故B正确;
C.同周期最高价氧化物对应水合物的酸性从左到右依次增强(Si、P同周期),同主族最高价氧化物对应水合物的酸性从上到下依次减弱(C、Si同主族),
则酸性强弱:H4SiO4<H2CO3<H3PO4,故C正确;
D.NaCl属于离子晶体,熔点较高,Na属于金属晶体,熔点较低,CO2属于分子晶体,熔点更低.也可以这样解答,根据所学知识,NaCl的熔点会高于100℃,Na的熔点低于100℃,而CO2常温下为气体.因此,溶点:NaCl>Na>CO2.故D正确;
故选A.
点评 本题考查的主要是同周期元素性质的递变规律,运用递变规律解题要判断是同周期还是同主族,才能正确运用规律.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol•L-1的Na2CO3溶液中CO32-的数目小于NA | |
| B. | 常温常压下,1.7g NH3中所含的原子数为0.4NA | |
| C. | 向含0.1mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为0.4NA | |
| D. | 标准状况下,4.48LNO2与足量的水反应,转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用. | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2Se>H2S | B. | 原子半径:Se>O | ||
| C. | 酸性:H2SO4>H2SeO4 | D. | 还原性:Se2->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片投入FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | AgCl悬浮液中加入Na2S溶液沉淀变黑:2AgCl+S2-═Ag2S+2Cl- | |
| C. | 用两根铁电极电解CuSO4溶液:2Cu 2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ | |
| D. | Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
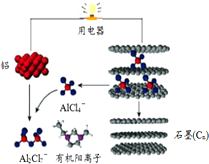 斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时,该电池负极应连接外接电源的负极 | |
| B. | 放电时,电子从铝流出经过电解质溶液到达石墨电极 | |
| C. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水的杀菌消毒 | B. | 氧化铁可用于红色油漆和涂料 | ||
| C. | 油脂可用于在碱性溶液制取肥皂 | D. | 含氮、磷的污水可用于给土壤施肥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com