
| A. | 铜片投入FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | AgCl悬浮液中加入Na2S溶液沉淀变黑:2AgCl+S2-═Ag2S+2Cl- | |
| C. | 用两根铁电极电解CuSO4溶液:2Cu 2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ | |
| D. | Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
分析 A.铜活泼性小于铁,二者反应生成亚铁离子和铜离子;
B.硫化银更难溶,实现了沉淀的转化;
C.电解为Fe棒,则阳极铁失去电子生成亚铁离子;
D.钙离子足量,反应生成碳酸钙沉淀.
解答 解:A.铜片投入FeCl3溶液中,反应生成了氯化亚铁和氯化铜,正确的离子方程式为:Cu+2Fe3+═2Fe2++Cu2+,故A错误;
B.AgCl悬浮液中加入Na2S溶液沉淀变黑,氯化银沉淀转化成了黑色的硫化银,反应的离子方程式为:2AgCl+S2-═Ag2S+2Cl-,故B正确;
C.用两根铁电极电解CuSO4溶液,阳极铁失去电子生成亚铁离子,阴极铜离子得到电子生成铜,正确的离子方程式为:Cu2++Fe$\frac{\underline{\;电解\;}}{\;}$Cu↓+Fe2+,故C错误;
D.Ca(HCO3)2溶液中加入澄清石灰水,反应生成碳酸钙沉淀和水,反应的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 若a+b<c+d,则反应一定能自发向右进行 | |
| B. | 若起始时A、B的物质的量之比为a:b,则平衡时的转化率之比为1:1 | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n molB,则平衡时气体的总物质的量小于(m+n)mol | |
| D. | 若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
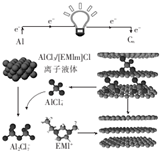 英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )
英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )| A. | 放电时,若外电路中转移1mol电子,则负极质量减少9g | |
| B. | 充电时,石墨烯作阳极 | |
| C. | 充电时,阴极的电极反应式为AlCl4-+3e-═Al+4Cl- | |
| D. | 放电时,正极的电极反应式为CW(AlCl4)+e-═CW+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 使用填埋法处理未经分类的生活垃圾 | 食用油脂能促进人体对某些维生素的吸收 | 利用二氧化碳可制造全降解塑料,有利于缓解温室效应 | 药皂中的少量苯酚,可起到杀菌消毒的作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定次数 | 盐酸体积(ml) | NaOH溶液体积读数(ml) | |
| 滴定前 | 滴定后 | ||
| 20.00 | 0.00 | 16.30 | |
| 2 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子数 | B. | 中子数 | C. | 质子数 | D. | 原子序数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com