
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为I A,通电时间为t min后,精确测得电极上析出铜的质量为m g。

试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接 ,C接 , 接F。
(2)写出B电极上发生的电极反应式: ;
G试管中淀粉KI溶液变化的现象为 ,
相应的离子方程式是 。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极 ④低温烘干电极后称量
⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA= 。
(1)D A B
(2)2Cl--2e=Cl2↑ 变蓝色 Cl2+ 2I-=I2+2Cl- (3)①③④⑥
(4)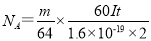
【解析】
试题分析:
(1)由于U形管右侧有一处理气体的支管,所以可推知B电极为有Cl2生成的一极,即为阳极。显然F应与B连接,A为阴极,结合电流表接入线路的物理知识,A应接C,D接E。
(2)电解CuCl2,阴、阳两极的电极反应式为:阴极:Cu2++2e=Cu;阳极:2Cl--2e=Cl2↑
生成的Cl2通入G试管,与KI反应,置换出I2,I2可使淀粉溶液呈现蓝色。
(3)为了精确测定电极上析出的铜的质量,显然应采用测定电解前后A电极增重的方法。具体操作为:在电解前先称量A电极的质量,电解后先用蒸馏水清洗电极(洗去附着的离子),然后需将电极烘干(除去附着的水),为防止Cu被氧化,应在低温下烘干后再进行称量,为防止误差,还应再低温烘干称量,直至恒重。
(4)电解时,当电流强度为IA,通电时间为tmin钟内,通过的总电量为:Q=ItC,通过的电子的物质的量为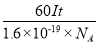 mol。由题意知阴极析出mgCu,转移的电子的物质的量为
mol。由题意知阴极析出mgCu,转移的电子的物质的量为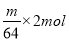 。由上述分析可建立等式:
。由上述分析可建立等式: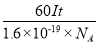
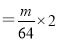 , 由此式即可得NA的表达式:
, 由此式即可得NA的表达式: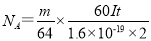 。
。
考点:考查电解池、理化仪器的使用、阿伏伽德罗常数的计算
点评:本题将物理中电路连接与化学中仪器连接相结合,将电学知识与电解原理相结合,并设置一个利用电解方法来验证阿佛加德罗常数的全新情境,具有一定的深度和灵活性。解题时应将理化相关知识有机融合,方能解决相关问题。


科目:高中化学 来源:2014-2015北京市东城区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列行为符合安全要求的是
A.金属钠着火时,立即用沾水的毛巾覆盖
B.配制稀硫酸时将水倒入浓硫酸中并不断搅拌
C.不慎洒出的酒精在桌上着火时,立即用水扑灭
D.大量氯气泄漏时,迅速离开现场并尽量往高处去
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:填空题
(11分)一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:

(1)80~90ml对应反应的离子方程式 。
(2)金属铝的质量为______ _
(3)盐酸的体积是 ml。
(4)a的取值范围是___ __。
(5)n(Mg)/n(Al)的最大值是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
材料与化学密切相关。下列物质与材料对应关系不正确的是
A.晶体硅——光导纤维 B.氧化铝——耐火材料
C.铁碳合金——碳素钢 D.硅酸盐——普通玻璃
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列说法错误的是
A.钠在空气中燃烧所得产物为Na2O2
B.镁因在空气中形成了一薄层致密的氧化膜,保护了里面的镁,故镁不需要像钠似的进行特殊保护
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.铁在潮湿的空气中因生成的氧化物很疏松,不能保护内层金属,故铁制品往往需涂保护层
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期第三次月考化学试卷(解析版) 题型:选择题
镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是
A.镁条作负极,电极反应:Mg-2e-=Mg2+
B.铝片作负极,电极反应:Al+4OH--3e--=AlO2-+2H2O
C.电流从Al电极沿导线流向Mg电极
D.铝片上有气泡产生
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期第三次月考化学试卷(解析版) 题型:选择题
已知反应A2(g)+2B2(g) 2AB2(g)的ΔH<0,下列说法正确的是
2AB2(g)的ΔH<0,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第一学期期末练习化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下, 所含的原子数为0.2NA
所含的原子数为0.2NA
B.常温下11.2L甲烷气体所含的分子数为0.5NA
C.18gD2O所含的电子数为10NA
D.1.5molNO2与足量水反应,转移的电子数为1.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高二上学期期末考试化学试卷(解析版) 题型:填空题
(12分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________。
(2)根据等电子原理,写出CO分子的结构式________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,若Na2CO3溶液的浓度为2×10—4mo1/L,现将等体积的CaCl2溶液与Na2CO3溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______mo1/ L。
(4)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子的空间构型是_____,中心碳原子的轨道杂化类型为_____。1 mol甲醛分子中σ键的数目为________。
②甲醇可制作燃料电池,以KOH溶液作电解质,向两极分别充入甲醇和空气,工作过程中,负极反应方程式为:___________________。
③已知在常温常压下:
CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H= -359.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H= -556.0 kJ·mol-1
H2O(g)=H2O(l) △H= -44.0 kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com