

| 交叉偶联 |
| 一定条件 |
 +CH3OH
+CH3OH| 一定条件 |
 “醇解反应”的反应类型为
“醇解反应”的反应类型为| HCN |
| H+ |
 ②R′COOH
②R′COOH| PCl3 |
| 浓硫酸 |
| 170℃ |
| Br |

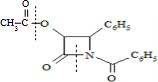 所示虚线发生化学键断裂,O原子、N原子连接甲醇中羟基中的H原子,-OCH3连接断键处的C原子;
所示虚线发生化学键断裂,O原子、N原子连接甲醇中羟基中的H原子,-OCH3连接断键处的C原子;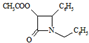 +HCl,X分子中含碳氮双键(C=N),应在如图
+HCl,X分子中含碳氮双键(C=N),应在如图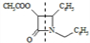 虚线所示位置是反应成键位置,故X为
虚线所示位置是反应成键位置,故X为 ,
, ;
;| 一定条件 |
 +CH3OH
+CH3OH| 一定条件 |
 ,可知-OCH3取代
,可知-OCH3取代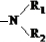 ,故酯和酰胺在过量醇中能发生醇解反应属于取代反应,由酰胺在过量醇中能发生醇解反应的信息可知,在如图
,故酯和酰胺在过量醇中能发生醇解反应属于取代反应,由酰胺在过量醇中能发生醇解反应的信息可知,在如图 所示虚线发生化学键断裂,O原子、N原子连接甲醇中羟基中的H原子,-OCH3连接断键处的C原子,故还生成CH3COOCH3,
所示虚线发生化学键断裂,O原子、N原子连接甲醇中羟基中的H原子,-OCH3连接断键处的C原子,故还生成CH3COOCH3, 或
或 ,
, 或
或 ;
; 或
或 ,
, 或
或 ;
; ,
, .
.


科目:高中化学 来源: 题型:
| A、硒也有两种氧化物,分别为SeO2和SeO3两种 |
| B、硒化氢属于共价化合物,比硫化氢稳定 |
| C、硒化氢的水溶液显弱酸性 |
| D、硒单质的非金属性比氧弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
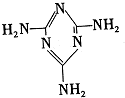 )俗称.蛋白精”,可以由下列反应合成:
)俗称.蛋白精”,可以由下列反应合成:
| ||
| ||
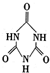 )后,两者之间易通过
)后,两者之间易通过
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
. |
| v |
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com