
【题目】下列化肥长期施用容易导致土壤酸化的是( )
A.硫酸铵B.尿素C.草木灰D.硝酸钾
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入到一定量的硝酸银和硝酸镁的混合液中,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则在滤渣中
A.一定有银、铁和镁 B.仅有银和铁
C.可能含镁 D.只有银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2被誉为生命的“信息分子”,在100℃时,将0.100mol的无色N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/molL﹣1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/molL﹣1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
从表中分析:该温度下,达平衡时N2O4的转化率=;反应N2O4(g)2NO2(g)的平衡常数=;升高温度,容器中气体的颜色变深,则反应2NO2(g)N2O4(g)的△H0(填:>、<、=);在上述条件下,60s内N2O4的平均反应速率= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠露置于空气中,观察到下列现象: 金属钠(银白色) ![]() 变
变 ![]() 变白色
变白色 ![]() 表面潮湿
表面潮湿 ![]() 形成白色晶体
形成白色晶体 ![]() 形成白色粉末
形成白色粉末
请回答下列问题:
(1)白色粉末的化学式是 , 过程②的化学方程式是 .
(2)下列说法正确的是 .
A.过程③为物理变化
B.过程④是碳酸钠吸收空气中的CO2、水蒸气形成了碳酸氢钠
C.过程⑤发生了分解反应
D.整个变化过程中只有一个氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你已有的知识和经验,分析下列过程的焓变、熵变,并判断反应的方向.
(1)H+(aq)+OH﹣(aq)=H2O (l)△S=+80.7Jmol﹣1K﹣1 , △H0,△S0,该反应(自发或非自发)
(2)TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+161.9kJmol﹣1,△S=﹣38.4Jmol﹣1K﹣1该反应(自发或非自发)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表,下列叙述中正确的是( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备超导体材料的元素
B. 在过渡元素中可以寻找制备催化剂及耐高温、耐腐蚀材料的元素
C. 在过渡元素区域可以寻找制备新型农药材料的元素
D. 非金属性最强的元素在元素周期表的最右上角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列各组仪器或装置,不能达到实验目的是( ) 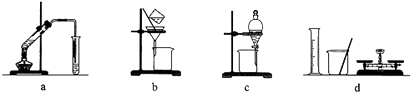
A.a组:制备少量乙酸乙酯
B.b组:除去粗盐水中的泥沙
C.c组:用CCl4提取碘水中的碘
D.d组:配制100 mL 1.00 mol/L NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1:2
B.1:4
C.2:1
D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)S2﹣中含有18个电子,画出S的原子结构示意图 .
(2)一水合氨(NH3H2O)是一种弱电解质,在水中可电离出铵根离子和氢氧根离子,试写出一水合氨的电离方程式 .
(3)正长石的组成可表示为KAlSi3Ox , 试根据化合价计算x= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com