
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是( )
A. 该化合物仅含碳、氢两种元素
B. 该化合物中碳、氢原子个数比为1:2
C. 无法确定该化合物是否含有氧元素
D. 该化合物中一定含有氧元素
科目:高中化学 来源: 题型:
【题目】硫-氨热化学循环制氢示意图如下:
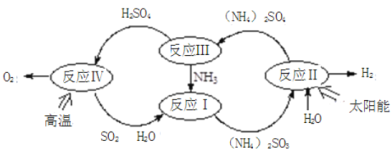
(1)反应Ⅱ是将太阳能转化为电能,再转化为化学能,电解池阳极的电极反应式 _______________;
(2)反应Ⅲ中控制反应条件很重要,不同条件下硫酸铵分解产物不同。连接装置A-B-C,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A 至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、B之间的导气管内有少量白色固体。经检验,该白色固体和装置B内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
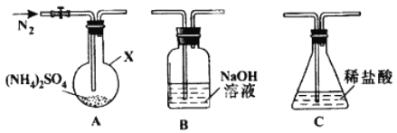
(NH4)2 SO4在400℃分解的化学方程式是:________________________________________;
(3)反应Ⅳ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O (l) △H=+462kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
iii.H2O(l)=H2O(g) △H=+44kJ/mol
①L(L1、L2),X可分别代表压强或温度。下图表示 L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
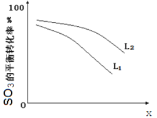
i.X代表的物理量是:________________,
ii.判断L1、L2的大小关系,并简述理由:________________________________________;
②反SO3分解的热化学方程式为:__________________________________________________;
(4)恒温密闭容器中,控制不同温度进行SO3分解实验。SO3起始浓度均为 cmol·L-1,测定SO3的转化率,结果如图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。
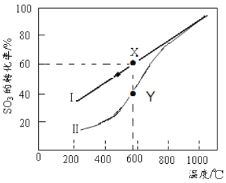
①图中点X点平衡常数:K=_____ ;
②Y点对应温度下的反应速率:v(正)______v(逆)(选填:>,<,=);随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z 原子的最外层电子数之和。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)上述元素两两形成的化合物中,溶于水显碱性的气态氢化物的电子式为 ,含有离子键和非极性共价键的化合物的电子式为 ;含有极性共价键和非极性共价键的化合物的电子式为 。
(2)由X、Y、Z所形成的常见离子化合物是 (写化学式),该化合物与[W的最高价氧化物对应水化物的浓溶液加热时反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,乳酸[CH3CH(OH)COOH]成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。请完成下列有关问题:
(1)写出乳酸分子中所有官能团的名称_____________。
(2)在一定条件下,下列物质不能与乳酸发生反应的是________。
A.溴水 B.NaOH溶液 C.Cu(OH)2悬浊液 D.C2H5OH
(3)如果以丙烯(CH2=CH—CH3)为主要原料(其他无机原料任选)合成乳酸,其合成过程的流程图如下:
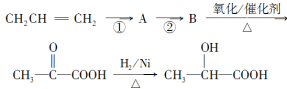
则①的反应类型是________;反应②的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法正确的是( )
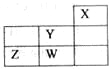
A. W的最高价氧化物对应的水化物是强酸
B. W的非金属性比Z的弱
C. Y的原子半径在同周期主族元素中最大
D. Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 利用金属活性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是( )
A.2Al2O3(熔融) ![]() 4Al+3O2↑
4Al+3O2↑
B.Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
C.Fe+CuSO4 ===FeSO4+Cu
D.2NaCl(水溶液)![]() 2Na+Cl2↑
2Na+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
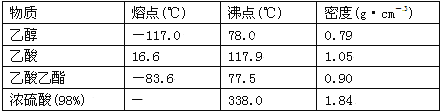
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;

③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为_______________________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)__________ __________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是________________________。
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(5)浓硫酸的作用是:① ;② 。
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(8)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是 ,该过程中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B两种物质混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),求:
(1)此时A的浓度c(A)=________及反应开始前放入容器中A、B的物质的量。n(A) =________;n(B) =________。
(2) B的平均反应速率。V(B) =________。
(3) X的值是多少?X=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列要求书写反应方程式,有要求的要注明反应类型。
1、乙烯与Br2的反应: 。反应类型: 。
2、乙烯制聚乙烯 :
3、苯与液溴的反应 : 。反应类型: 。
4、乙醇与金属钠的反应:
5、乙醇的催化氧化反应:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com