
【题目】常温下,0.1molL﹣1某一元酸(HA)溶液中 ![]() =1×10﹣8 , 相同物质的量浓度的某一元碱(BOH)溶液中
=1×10﹣8 , 相同物质的量浓度的某一元碱(BOH)溶液中 ![]() =1×1012 , 下列叙述正确的是( )
=1×1012 , 下列叙述正确的是( )
A.HA的pH=3;BOH的pH=13
B.pH=a的HA溶液,稀释10倍,其pH=a+1
C.等体积的HA和BOH恰好完全反应,溶液的pH=7
D.相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同
【答案】A
【解析】解:A.常温下,溶液中 ![]() =1×10﹣8、Kw=c(H+)c(OH﹣)=1×10﹣14 , 联立解得c(H+)=10﹣3mol/L,该溶液的pH=3;联立
=1×10﹣8、Kw=c(H+)c(OH﹣)=1×10﹣14 , 联立解得c(H+)=10﹣3mol/L,该溶液的pH=3;联立 ![]() =1×1012、Kw=c(H+)c(OH﹣)=1×10﹣14解得:c(OH﹣)=10﹣1mol/L,该溶液的pH=13,故A正确;B.根据A可知.0.1molL﹣1某一元酸(HA)溶液的pH=3,说明HA为弱酸,稀释后电离程度增大,溶液中氢离子浓度增大,则溶液的pH小于a+1,故B错误;
=1×1012、Kw=c(H+)c(OH﹣)=1×10﹣14解得:c(OH﹣)=10﹣1mol/L,该溶液的pH=13,故A正确;B.根据A可知.0.1molL﹣1某一元酸(HA)溶液的pH=3,说明HA为弱酸,稀释后电离程度增大,溶液中氢离子浓度增大,则溶液的pH小于a+1,故B错误;
C.0.1molL﹣1的BOH溶液的pH=13,说明BOH为强电解质,两溶液等体积混合后生成强碱弱酸盐,溶液显示碱性,故C错误;
D.HA为弱酸,在溶液中只能部分电离出氢离子,pH相等的HA和盐酸中,HA的物质的量浓度大于盐酸,则相同体积相同pH的HA和盐酸分别与足量Zn反应,HA产生的氢气多,故D错误;
故选A.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】5.4g M 和16.0g N 恰好完全反应,生成0.2mol X 和10.2gY,则X 的摩尔质量为
A. 112 g/mol B. 28 g/mol C. 56 g/mol D. 84 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用SiO2与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1:1.下列说法正确的是( )
A.SiC是一种新型无机非金属材料,任何条件下都不可能在空气中燃烧
B.制造粗硅时的反应:2SiO2+5C ![]() ?Si+SiC+4CO↑
?Si+SiC+4CO↑
C.Si、SiO2能用NaOH溶液分离
D.纯净的SiO2只能用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列诗句不涉及化学反应的是( )
A.爆竹声中一岁除,春风送暖入屠苏
B.飒飒西风满院栽,蕊寒香冷蝶难来
C.春蚕到死丝方尽,蜡炬成灰泪始干
D.开视化为血,衰今征敛无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图所示:
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨)mL,用规格为mL量筒量取.
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42﹣外,还有大量的NH4+ . 检验NH4+的方法是 .
(3)写出沉淀物中所有物质的化学式 .
(4)滤液I的成分是水和 .
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:①称取钾氮肥试样并溶于水,加入足量溶液,产生白色沉淀.
②、、(依次填写实验操作名称).
③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:mol(用含m、n的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq).一定温度下,下列有关该反应的推理正确的是( )
A.该反应达到平衡时c(Cu2+)=c(Mn2+)
B.平衡体系中加入少量CuS(s)后,c(Mn2+)变小
C.平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D.该反应的平衡常数K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:
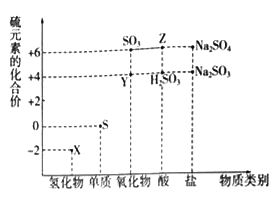
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用元素周期律原理解释的是
A.金属性:K>NaB.气态氢化物的稳定性:H2O>NH3
C.酸性:HCl>H2SO3D.Br2从NaI溶液中置换出I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜.制备方法如下:Ⅰ.方法一:
(1)浓硫酸试剂瓶上适合贴上的标签是(填序号).
(2)甲同学取6.4 g铜片和10 mL 18 molL﹣1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀.甲同学为了验证其中白色沉淀主要成分.设计下列实验:实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌.
实验现象:;
实验结论:所得白色固体的化学式为 .
(3)乙还观察到加热过程中,起初液面以上出现大量白色烟雾,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失.淡黄色固体消失的原因是(用化学反应方程式回答) . 直到最后反应完毕,发现试管中还有铜片剩余.乙根据自己所学的化学知识,认为试管中还有硫酸剩余.他这样认为的理由是 .
(4)Ⅱ.方法二:丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2 ![]() 2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是① , ② .
2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是① , ② .
(5)方法三:丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色.写出反应的化学反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com