
【题目】中华传统文化蕴含着很多化学科学知识,下列说法不正确的是
A.“丹砂(HgS)烧之成水银,积变又还成丹砂”描述的是可逆反应
B.“水声冰下咽,沙路雪中平”未涉及化学变化
C.“烈火焚烧若等闲”涉及的反应在高温下自发进行
D.“洪炉照破夜沉沉”中涉及的反应是放热反应
【答案】A
【解析】
A. 可逆反应的要求是正逆反应的条件要相同、同时进行,“丹砂(HgS)烧之成水银”是指HgS受热分解生成汞单质和硫单质,“积变又还成丹砂”是指硫和汞又化合生成硫化汞,二者反应条件不同,不属于可逆反应,故A错误;
B. “水声冰下咽,沙路雪中平” 是水的三态变化,过程中没有新物质生成,未涉及化学变化,故B正确;
C. “烈火焚烧若等闲”涉及的反应是碳酸钙高温下受热分解生成氧化钙和二氧化碳,该反应是吸热反应,![]() >0,正反应方向是混乱度增大的过程,
>0,正反应方向是混乱度增大的过程,![]() >0,根据复合判据
>0,根据复合判据![]() -T
-T![]() ,在高温下
,在高温下![]() -T
-T![]() <0可以自发进行,故C正确;
<0可以自发进行,故C正确;
D. 该句出自于谦的《咏煤炭》:“凿开混沌得乌金,藏蓄阳和意最深”指的是煤的开采,“爝火燃回春浩浩,洪炉照破夜沉沉”,乌金指的是煤,煤炭燃烧发出红色的火焰照亮黑夜,所有的燃烧都属于放热反应,故D正确;
答案选A。


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】(1)![]() 溶液呈碱性的原因是 ______
溶液呈碱性的原因是 ______ ![]() 写出有关的离子方程式
写出有关的离子方程式![]() ,将
,将![]() 溶液跟
溶液跟![]() 溶液混合,相关反应的离子方程式是 ______ .
溶液混合,相关反应的离子方程式是 ______ .
(2)现有浓度均为![]() 的
的![]() 溶液与
溶液与![]() 溶液,试回答下列问题:
溶液,试回答下列问题:
![]() 大小:
大小:![]() ______
______ ![]() 填
填![]() 、
、![]() 、
、![]() ;
;
![]() 微粒种类:
微粒种类:![]() ______
______ ![]()
![]() 填
填![]() 、
、![]() 、
、![]() ;
;
![]() 两溶液分别加入
两溶液分别加入![]() 固体,恢复到原温度,
固体,恢复到原温度,![]() 溶液中的
溶液中的![]()
______ ![]() 填“增大、减小或不变”
填“增大、减小或不变”![]() 、
、![]() 溶液中的
溶液中的![]() ______
______ ![]() 填“增大、减小或不变”
填“增大、减小或不变”![]() .
.
(3)常温下,甲为![]() 的HA溶液,
的HA溶液,![]() ;乙为
;乙为![]() BOH溶液,且溶液中
BOH溶液,且溶液中![]()
![]() 请分别写出甲、乙两溶液中溶质的电离方程式 ______ 、 ______ .
请分别写出甲、乙两溶液中溶质的电离方程式 ______ 、 ______ .
(4)相同条件下,对于浓度均为![]() 的NaCl溶液和
的NaCl溶液和![]() 溶液,溶液中的离子总数:NaCl溶液 ______
溶液,溶液中的离子总数:NaCl溶液 ______ ![]() 溶液
溶液![]() 填
填![]() 、
、![]() 、
、![]() .
.
(5)物质的量浓度相同的![]() 氨水
氨水![]() 氯化铵
氯化铵![]() 碳酸氢铵
碳酸氢铵![]() 硫酸氢铵
硫酸氢铵![]() 硫酸铵五种溶液中
硫酸铵五种溶液中![]() 由大到小的顺序是
由大到小的顺序是![]() 填写编号
填写编号![]() _____
_____
(6)浓度均为![]() 的6种溶液:
的6种溶液:![]()
![]()
![]()
![]()
![]()
![]() ,溶液pH值由小到大的顺序是
,溶液pH值由小到大的顺序是![]() 填写编号
填写编号![]() ______ .
______ .
(7)在钢铁发生的吸氧腐蚀中正极上的电极反应式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnCl4是一种极易水解的化合物,它的制备需要在无水的条件下,密闭的装置中进行。若用常规(系统的体积较大)方法进行多实验缺点比较多,下图采用微型实验进行SnCl4 的制备,解决了常规方法的弊端(己知:SnCl4的熔点为-33℃,沸点为114.1℃)。
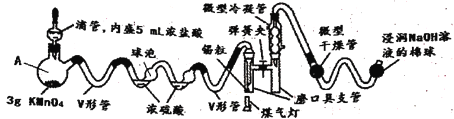
(1)将已干燥的各部分仪器按图连接好后,需要进行的操作为________________________。
(2)V形管的作用是________________________________________________________。
(3)下列说法中正确的是_____
A.仪器A的名称为蒸馏烧瓶
B.为了充分干燥氯气,浓硫酸的体积应大于球泡的体积
C.操作时应先滴加浓盐酸,使整套装置内充满黄绿色气体,再用煤气灯加热
D.生成的SnCl4蒸气经冷却聚集在磨口具支管中
E.微型干燥管中的试剂可以是碱石灰、五氧化二磷或无水氯化钙等
(4)实验中0.59锡粒完全反应制得1.03g SnCl4,则该实验的产率为_____________(计算结果保留一位小数)。
(5)SnCl4遇氨及水蒸气的反应是制作烟幕弹的原理,反应的化学方程式为_______________。
(6)该微型实验的优点是________________________________________________(任写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α,β,γ和δ4种生育三烯酚(见下图)是构成维生素E的主要物质,下列叙述中不正确的是( )
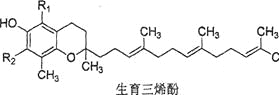
α β γ δ | |
R1 | CH3 CH3 H H |
R2 | CH3 H CH3 H |
A.α和β两种生育三烯酚互为同系物,β和γ两种生育三烯酚互为同分异构体
B.4种生育三烯酚均可使酸性高锰酸钾溶液褪色
C.4种生育三烯酚都难溶于水
D.1molδ生育三烯酚与溴水发生反应,理论上最多可消耗3molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的碳酸钙与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如下图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 | 对应曲线 | c(HCl) / mol·L-1 | 反应温度 / ℃ | 铁的状态 | |
1 | a | 30 | 粉末状 | ||
2 | b | 30 | 粉末状 | ||
3 | c | 2.5 | 块状 | ||
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢
B. 第1组实验中盐酸的浓度可能最大
C. 第2组实验中盐酸浓度可能等于2.5mol/L
D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列问题:
K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有______(填元素名称)。
(2)以上元素中,属于s区的元素有_____种,属于d区的元素有______种。
(3)第一电离能I1(Cr)________I1(Co)(填“>”、“<”或“=”,下同)。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。试推断紫色晶体的化学式为_________。
。试推断紫色晶体的化学式为_________。
(5)含有元素K的盐的焰色反应为__________色。许多金属盐都可以发生焰色反应,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酸为原料制备胡椒乙酸的合成路线如图所示。回答下列问题:
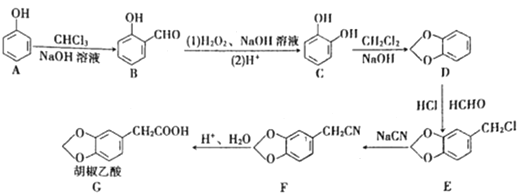
(1)下列关于有机物B的说法正确的是______![]() 填字母
填字母![]() 。
。
a.能与FeCl3溶液发生显色反应 b.核磁共振氢谱中只有3组峰
c.能发生银镜反应 d.能与溴水发生加成反应
(2)有机物C的名称是______,C→D的反应类型是______。
(3)胡椒乙酸(G)的分子式为______,G所含官能团的名称为______。
(4)E生成F的化学方程式为______。
(5)W是G的芳香族化合物同分异构体,0.5molW与足量碳酸氢钠溶液反应生成1molCO2,则W的结构共有______(不含立体异构)种,其中苯环上有2个取代基,且核磁共振氢谱有5组峰的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
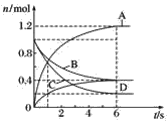
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如下图所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_______(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是___________________;装置D的作用是___________________。
③装置C中发生反应的化学方程式为________________________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_____________________________。
⑤该装置存在的主要缺陷是___________________________________________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。

①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是___________,U型管中加入的试剂是___________。
②此装置能产生大量氨气的原因是___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com