
 下列各组物质中,不能按 (“→”表示一步完成)关系相互转化的是( )
下列各组物质中,不能按 (“→”表示一步完成)关系相互转化的是( )
| 选项 | A | B | C | D |
| a | Fe | CO2 | Al(OH)3 | AlCl3 |
| b | FeCl3 | Na2CO3 | NaAlO2 | Al(OH)3 |
| c | FeCl2 | NaHCO3 | Al2O3 | NaAlO2 |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
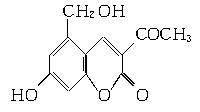 2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式
___________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与3 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列三个氧化还原反应:① 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2 ;②2FeCl2 + Cl2 = 2FeCl3 ;③ 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O。若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不使Fe2+和Cl-的量减少,可加入的试剂是
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、Al、Fe四种金属的熔、沸点如下表所示:
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2467 | 2750 |
其中不能形成合金的是( )。
A.Cu与Na B.Fe与Cu C.Fe与Al D.Al与Na
查看答案和解析>>
科目:高中化学 来源: 题型:
中国西部地区自然资源丰富,在矿产资源中,钛、铜、汞、铅、锌等30多种矿产储量居全国第一,攀枝花的矾钛铁矿、云南的锡矿等在全国占十分重要的地位。
(1)矾钛铁矿的主要成分可用化学式VaTibFecOx来表示,其中V显+5价,Ti显+4价,Fe显+3价,则x的值是________(用含a、b、c的代数式表示)。
(2)经分离矾钛铁矿石最终可得V2O5、TiO2等物质,试写出V2O5跟Al粉反应的化学方程式________。
(3)已知TiO2+2C+2Cl2 TiCl4+2CO,Cl2+2NaOH==NaCl+NaClO+H2O。某化学兴趣小组设计一套实验装置利用上述反应以制得TiCl4,装置中尾气处理部分如图(Ⅰ)所示,瓶中应加入________溶液,在导管口B处应________。
TiCl4+2CO,Cl2+2NaOH==NaCl+NaClO+H2O。某化学兴趣小组设计一套实验装置利用上述反应以制得TiCl4,装置中尾气处理部分如图(Ⅰ)所示,瓶中应加入________溶液,在导管口B处应________。
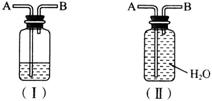
(4)装置图(Ⅱ)不能用于收集下列气体中的( )(填序号)。
A.CO B.HCl C.O2 D.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
铝硅合金(含Si 13.5%)在凝固时的收缩率很小,因而这种合金适合铸造。①铝、②硅、③铝硅合金、④铝粉四种物质,其中熔点最低的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.NH3溶于水后所得溶液显碱性,在硫酸铜溶液中加入足量氨水可产生氢氧化铜沉淀
B.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污
C.次氯酸钠具有强还原性,可用于配制“84”消毒液
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = ▲ 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图3:
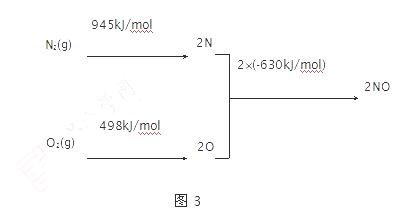
① N2(g)+O2(g) 2NO(g) ΔH= ▲ kJ·mol-1。
2NO(g) ΔH= ▲ kJ·mol-1。
② 尾气中空气不足时,NOx在催化转化器中被还原成N2。写出NO被CO还原的化学方程式 ▲ 。
③ 汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的ΔH>0,该设想能否实现? ▲ (填“能或不能”)。依据是 ▲ 。
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图4:
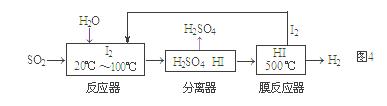
① 用离子方程式表示反应器中发生的反应 ▲ 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素在元素周期表中的位置为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
(5)下图是一个电化学过程示意图。
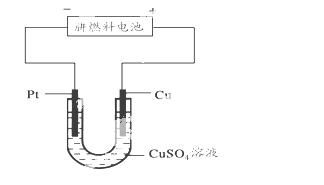
①写出铂片上发生的电极反应式____ ____。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128 g,则肼-空气燃料电池理论上消耗标准状况下的空气_____ ___L(假设空气中氧气体积含量为20%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com