
【题目】大家都知道,H2S、SO2、NO和CO都是常见的大气污染物,治理污染优化环境对人类的生产与生活尤为重要。
(1)H2S和SO2都是来自硫酸工业的污染物,下列说法正确的是___________。
A .两气体均可以用浓硫酸来干燥 B. 两气体可以用溴水来鉴别
C. 两气体均可以用氢氧化钠溶液来吸收 D. SO2使KMnO4溶液褪色表现出漂白性
(2)汽车尾气的主要成分是氮的氧化物和CO,目前用在汽车的排气管上安装催化转化装置,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) 来除去这两种污染物。有人设想按下列反应:2CO(g)=2C(s)+O2(g)来除去CO,已知该反应为吸热反应,则该设想能否实现___选填“能”或“不能”),理由是_______________________________________。
N2(g)+2CO2(g) 来除去这两种污染物。有人设想按下列反应:2CO(g)=2C(s)+O2(g)来除去CO,已知该反应为吸热反应,则该设想能否实现___选填“能”或“不能”),理由是_______________________________________。
(3)为减少SO2的排放,常采用的措施是,将煤转化为清洁气体燃料。
已知:
2H2(g)+ O2(g)=2H2O(g) △H=-483.6kJ/mol
2C(s) + O2(g)=2CO(g) △H=-221kJ/mol
请写出焦炭与水蒸气反应的热化学方程式________________。
(4)根据(2)中汽车尾气净化原理,若该反应为放热反应,且该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应进行到t1时刻时达到平衡状态的是____。(填序号,下图中的v正、K、n、W分别表示正反应速率、平衡常数、物质的量、质量分数。)

【答案】 BC 不能 反应能发生的条件是:△G=△H-T△S<0,而该反应的△H>0,△S<0,所以△G>0 C(S) + H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol BD
【解析】(1)A .H2S能被浓硫酸氧化,不能用浓硫酸来干燥,A错误;B. H2S与溴水反应生成单质硫沉淀,SO2与溴水反应生成硫酸和溴化氢,因此两气体可以用溴水来鉴别,B正确;C. 两气体均可以用氢氧化钠溶液来吸收,C正确;D. SO2使KMnO4溶液褪色表现出还原性,D错误,答案选BC;(2)由于反应能发生的条件是:△G=△H-T△S<0,而该反应的△H>0,△S<0,所以△G>0,因此该设想不能实现。(3)已知:
①2H2(g)+ O2(g)=2H2O(g) △H=-483.6kJ/mol
②2C(s) + O2(g)=2CO(g) △H=-221kJ/mol
根据盖斯定律可知(②-①)/2即得到焦炭与水蒸气反应的热化学方程式为C(s) + H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol。(4)A、t1时正反应速率仍然在变化,说明没有达到平衡状态,A错误;B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,B正确;C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,C错误;D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,D正确;答案选BD。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( ) 
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+ .
A.①②③
B.③④⑤
C.④⑤⑥
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M由两种元素组成,某研究小组按如图流程探究其组成:
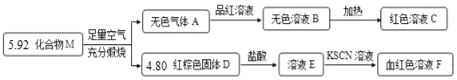
请回答:
(1)在制作印刷电路板的过程中常利用铜与溶液E的反应,反应的化学方程式为_____。
(2)将气体A通入溶液E中,溶液由黄色变成浅绿色,且酸性明显增强.写出该反应的离子方程式_____。
(3)化合物M的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属钛、铬、铁、镍、铜等金属及其化合物在工业上有用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①Ti的基态原子价电子排布式为_________。
②Fe元素在周期表中的位置是_________。
(2)制备 CrO2Cl2的反应为 K2Cr2O7+3CCl4=2KCl+2 CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序________。(用元素符号表示)
②COCl2分子中所有原子均满足8电子构型,COCl2分子中π键和σ键的个数比为____,中心原子的杂化方式为_______。
(3)NiO、FeO的晶体结构均与NaCl的晶体结构相似,其中Ni2+和Fe2+的离子半径分別为6.9×10-2nm和7.8×10-2nm。则熔点:FeO_____(填“>”“<”或“=” )NiO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化.该合金的晶胞结构如图所示。

①该晶体的化学式为__________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg/cm3。设NA为阿伏加徳罗常数的值,则该晶胞的体积是_______(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较温定。
已知:a=511pm,c=397pm;标准状况下氢气的密度为8. 98×10-5g/cm3;
![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用5mL的0.2 mol·L—1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
A. 3:2:1 B. 1:2:3 C. 1:3:3 D. 3:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com