
【题目】用5mL的0.2 mol·L—1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
A. 3:2:1 B. 1:2:3 C. 1:3:3 D. 3:1:1
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】大家都知道,H2S、SO2、NO和CO都是常见的大气污染物,治理污染优化环境对人类的生产与生活尤为重要。
(1)H2S和SO2都是来自硫酸工业的污染物,下列说法正确的是___________。
A .两气体均可以用浓硫酸来干燥 B. 两气体可以用溴水来鉴别
C. 两气体均可以用氢氧化钠溶液来吸收 D. SO2使KMnO4溶液褪色表现出漂白性
(2)汽车尾气的主要成分是氮的氧化物和CO,目前用在汽车的排气管上安装催化转化装置,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) 来除去这两种污染物。有人设想按下列反应:2CO(g)=2C(s)+O2(g)来除去CO,已知该反应为吸热反应,则该设想能否实现___选填“能”或“不能”),理由是_______________________________________。
N2(g)+2CO2(g) 来除去这两种污染物。有人设想按下列反应:2CO(g)=2C(s)+O2(g)来除去CO,已知该反应为吸热反应,则该设想能否实现___选填“能”或“不能”),理由是_______________________________________。
(3)为减少SO2的排放,常采用的措施是,将煤转化为清洁气体燃料。
已知:
2H2(g)+ O2(g)=2H2O(g) △H=-483.6kJ/mol
2C(s) + O2(g)=2CO(g) △H=-221kJ/mol
请写出焦炭与水蒸气反应的热化学方程式________________。
(4)根据(2)中汽车尾气净化原理,若该反应为放热反应,且该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应进行到t1时刻时达到平衡状态的是____。(填序号,下图中的v正、K、n、W分别表示正反应速率、平衡常数、物质的量、质量分数。)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在8NH3+3Cl2 == N2 + 6NH4Cl反应中,有21.3克氯气参加了反应,则被氧化的NH3的质量是( )
A. 13.6克 B. 10.2克 C. 34克 D. 3.4克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1mol/L的NaCl 溶液,下列有关说法正确的是( )
A.Na+的数目为NAB.Cl-的物质的量为1mol
C.Cl-的物质的量浓度为1mol/LD.NaCl的质量为58.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
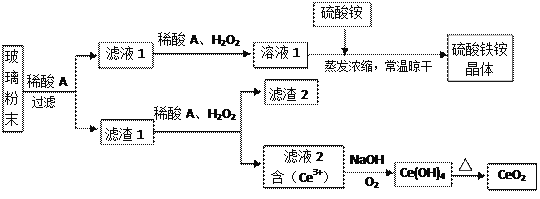
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是_________________________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为___________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式_____________________________________________________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理。相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。
该产品中Ce(OH)4的纯度为__________________。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表如示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
容器的体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A. 甲中反应的平衡常数小于乙 B. 该温度下,该反应的平衡常数K为400
C. SO2的平衡转化率:α1>α2=α3 D. 容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com