
【题目】在8NH3+3Cl2 == N2 + 6NH4Cl反应中,有21.3克氯气参加了反应,则被氧化的NH3的质量是( )
A. 13.6克 B. 10.2克 C. 34克 D. 3.4克
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】化合物M由两种元素组成,某研究小组按如图流程探究其组成:
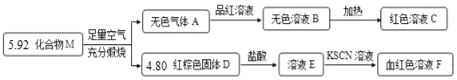
请回答:
(1)在制作印刷电路板的过程中常利用铜与溶液E的反应,反应的化学方程式为_____。
(2)将气体A通入溶液E中,溶液由黄色变成浅绿色,且酸性明显增强.写出该反应的离子方程式_____。
(3)化合物M的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属钛、铬、铁、镍、铜等金属及其化合物在工业上有用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①Ti的基态原子价电子排布式为_________。
②Fe元素在周期表中的位置是_________。
(2)制备 CrO2Cl2的反应为 K2Cr2O7+3CCl4=2KCl+2 CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序________。(用元素符号表示)
②COCl2分子中所有原子均满足8电子构型,COCl2分子中π键和σ键的个数比为____,中心原子的杂化方式为_______。
(3)NiO、FeO的晶体结构均与NaCl的晶体结构相似,其中Ni2+和Fe2+的离子半径分別为6.9×10-2nm和7.8×10-2nm。则熔点:FeO_____(填“>”“<”或“=” )NiO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化.该合金的晶胞结构如图所示。

①该晶体的化学式为__________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg/cm3。设NA为阿伏加徳罗常数的值,则该晶胞的体积是_______(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较温定。
已知:a=511pm,c=397pm;标准状况下氢气的密度为8. 98×10-5g/cm3;
![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下64 g S4和S8混合物中含有原子数为2NA
B. 标准状况下,22.4LHF中含电子数为10NA
C. 标准状况时,2.24LNO和1.12LO2于密闭容器中充分反应后,其分子数为0.1NA
D. 足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A. Fe(OH)3胶体、白磷、石灰乳B. 干冰、铁、氯化氢
C. 烧碱、液态氧、碘酒D. 空气、氮气、明矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用5mL的0.2 mol·L—1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
A. 3:2:1 B. 1:2:3 C. 1:3:3 D. 3:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁易被氧化而变质。为检验某补血剂中硫酸亚铁是否变质,可向该补血剂配成的溶液中加入
A.AgNO3溶液B.盐酸酸化的BaCl2溶液
C.KSCN溶液D.HNO3酸化的Ba(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com