
分析 (1)反应2min 时,A的浓度减少了$\frac{1}{3}$,则△c(A)=$\frac{1}{3}$×$\frac{amol}{2L}$=$\frac{1}{6}$amol/L,再根据v=$\frac{△c}{△t}$计算用A、B表示的反应速率;
(2)根据浓度据转化之比等于化学计量数之比;
(3)根据方程式计算消耗B的物质的量,B的转化率=$\frac{B的转化量}{B的初始量}$×100%计算.
(4)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断.
解答 解:(1)反应2min 时,A的浓度减少了$\frac{1}{3}$,则△c(A)=$\frac{1}{3}$×$\frac{amol}{2L}$=$\frac{1}{6}$amol/L,则v(A)=$\frac{\frac{1}{6}mol/L}{2min}$=$\frac{a}{12}$(L•min);B的物质的量减少了$\frac{a}{2}$mol,则△c(B)=$\frac{\frac{a}{2}mol}{2L}$=$\frac{a}{4}$mol/L,v(B)=$\frac{\frac{a}{4}mol/L}{2min}$=$\frac{a}{8}$mol/(L•min);
故答案为:$\frac{a}{12}$mol/(L•min);$\frac{a}{8}$mol/(L•min);
(2)根据(1),△c(A)=$\frac{1}{6}$amol/L,△c(B)=$\frac{a}{4}$mol/L,由题vC=$\frac{1}{2}$vA;则△c(C)=$\frac{1}{2}$△c(A)=$\frac{a}{12}$
mol/L,△c(C)=$\frac{amol}{2L}$=$\frac{a}{2}$mol/L,则m:n:p:q=$\frac{1}{6}$a:$\frac{1}{4}$a:$\frac{1}{12}$a:$\frac{1}{2}$a=2:3:1:6;
故答案为:m=2,n=3,p=1,q=6;
(3)反应达到平衡时,D为2amol,由方程式2A(g)+3B(g)=C(g)+6D(g)可知消耗的B为2amol×$\frac{3}{6}$=amol,故B的转化率为$\frac{a}{b}$;
故答案为:$\frac{a}{b}$;
(4)A.反应是一个前后系数和变化的反应,当容器内的压强保持不变,证明达到了平衡,故正确,
B.容器内的密度=$\frac{m}{V}$,质量守恒,V不变化,密度始终不变,所以当密度不变,不一定平衡,故错误;
C.容器内气体的质量始终不变,不一定平衡,故错误;
D.A,B,C,D的速率比始终为其化学计量数之比,不一定平衡,故错误;
E.A为有色气体,混合气体的颜色不再改变,证明达到了平衡,故正确;
F.混合气体的平均相对分子质量不再改变,混合气体的平均相对分子质量M=$\frac{m}{n}$,质量守恒,n变化,所以当M不变,证明达到了平衡,故正确;
G.化学反应速率之比等于系数之比,vB(正)=vC(逆)不能说明正逆反应速率相等,故错误;
故答案为:AEF.
点评 本题考查化学平衡的计算、反应速率计算,题目难度中等,根据反应速率关系以及物质的量的转化关系判断反应的化学方程式是解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 (mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
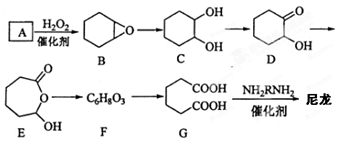
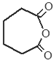 .
. .
.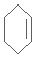 $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$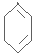 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
氨水中所含的分子和离子有 
①NH4+ ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com