
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 (mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
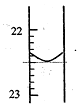
分析 (1)由图可知,22~23有10个刻度,滴定管的感量为0.01mL;
(2)实验1中消耗NaOH为22.50mL,误差较大,舍弃;则消耗NaOH为$\frac{18.56mL+18.54mL}{2}$=18.55mL,结合n(NaOH)=n(HCl)计算;
(3)由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,不当操作使V(NaOH)偏大,则会造成测定结果偏高.
解答 解:(1)由图可知,22~23有10个刻度,滴定管的感量为0.01mL,则则第一次实验滴定完用去NaOH溶液的体积记录为22.50mL,故答案为:22.50;
(2)实验1中消耗NaOH为22.50-0.10=22.40mL,误差较大,舍弃;则消耗NaOH为$\frac{18.56mL+18.54mL}{2}$=18.55mL,则0.01855L×0.1mol/L=c(盐酸)×0.02L,解得c(盐酸)=0.09275mol/L,故答案为:0.09275mol/L;
(3)A.滴定终点时俯视读数,V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故A选;
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故B选;
C.锥形瓶水洗后未干燥,对实验无影响,故C不选;
D.配制NaOH标准溶液,定容时仰视,c(NaOH)偏大,消耗的V(NaOH)偏小,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏低,故C不选;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故E选;
故答案为:ABE.
点评 本题考查中和滴定实验,为高频考点,把握仪器的使用、滴定原理、数据处理及误差分析为解答的关键,侧重分析与实验能力的考查,注意结合计算式分析误差,题目难度不大.


科目:高中化学 来源: 题型:实验题
 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  CH3+Cl2$\stackrel{光照}{→}$ CH3+Cl2$\stackrel{光照}{→}$ CH2Cl+HCl CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$ 2CH3CHO+2H2O | |
| C. | ClCH2═CH2+NaOH$→_{△}^{水}$ HOCH2CH═CH2+NaCl | |
| D. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ NO2+H2O NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
现有0.01mol/L的下列溶液:①CH3COOH ②NaHCO3 ③NaHSO4 ④KOH ⑤H2SO4按pH由小到大的顺序排列的是 ( )
A.⑤③①②④ B.③⑤① ②④ C.⑤②③①④ D.④②①③⑤
②④ C.⑤②③①④ D.④②①③⑤
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
向含有c(FeCl3)=0.2 mol·L-1、c(FeCl2)=0.1 mol·L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3 nm的金属氧化物,下列有关说法中正确的是
A.该分散系的分散质为Fe2O3
B.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷
C.可用过滤的方法将黑色金属氧化物与Na+分离开
D.加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-=Fe3O4+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com