
 .
. 分析 反应中N元素化合价由-3价升高到+2价,O元素化合价由0价降低到+2价,反应中O2为氧化剂,NH3为还原剂,结合化合价的变化解答该题.
解答 解:(1)反应中O元素得电子,化合价降低,N元素失电子,化合价升高,被氧化,反应中氧气为氧化剂,NH3为还原剂,N元素失去电子被氧化,氧化产物为NO,
故答案为:氧气;N;NO;
(2)反应中O元素化合价由0价降低到-2价,若有1molO2参加,则反应中转移电子是4mol,故答案为:4;
(3)反应中O元素得电子,化合价降低,N元素失电子,化合价升高,转移电子数目为20,电子转移的方向和数目可表示为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的表示方法,题目难度不大.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:推断题

 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1NA | |
| B. | 常温常压下,7.1g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,1L溶液中含有Cl-个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | CaO+H2O═Ca(OH)2 | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
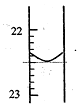 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 (mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
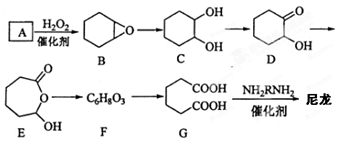
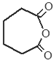 .
. .
.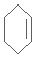 $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$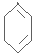 .
.查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成: ,下列说法不正确的是( )
,下列说法不正确的是( )
A.香芹酮的分子式为C10H14O
B.Cyrneine A可以发生加成反应、消去反应和氧化反应
C.香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D.与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com