
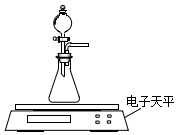
 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |
分析 (1)①碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,据此书写化学方程式;
②测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率,可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率;
(2)(i)在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率;
(ⅱ)据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验.
解答 解:(1)①碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率,
故答案为:生成二氧化碳的体积和反应时间;消耗碳酸钙固体的质量和反应时间;
(2)①在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率,
故答案为:生成等质量二氧化碳所需时间;
②据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验,
| 物理量 实验序号 | V(0.1mol/L的HCl)/mL | m(块状碳酸钙质量)/g | m(粉末状碳酸钙质量)/g | V(蒸馏水)/mL | m(二氧化碳)/g | 反应时间 t/s |
| 实验1 | a | b | c | d | ||
| 实验2 | a | b | c | d | ||
| 实验3 | c | b | a | d |
点评 本题考查了化学反应速率的求算以及化学反应速率的实验测定,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是 ( )
A.MgO B.MgCO3 C.NaOH D.Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油加水作护肤剂 | |
| B. | 医用酒精的浓度为75% (体积比浓度) | |
| C. | 福尔马林是甲醛的水溶液,具有杀菌防腐能力,因此可以用其保鲜鱼肉等食品 | |
| D. | 苯酚有毒但可以制成药皂,具有杀菌消毒的功效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
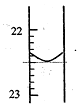 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 (mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com